Карбонатна система
Карбонатна система — сукупність послідовних реакцій, починаючи з розчинення діоксиду вуглецю у воді і кінчаючи випаданням нерозчинних карбонатів кальцію і магнію, що забезпечує кругообіг вуглецю: У хімії океану карбонатна система відіграє важливу роль в трьох основних процесах: у взаємодії на межі атмосфера — океан (поглинання діоксиду вуглецю), у біохімічних реакціях фотосинтезу і розкладання органічної речовини і в зміні кислотності морської води і випаданні нерозчинних карбонатних осадів. Буферність морської води, яка в основному залежить від карбонатної системи, має величезне значення для протікання усіх фізико-хімічних процесів в океані. Стабільність кислотних умов є, можливо, найістотнішим чинником, відповідальним за виникнення і підтримку життя в океані. Можливо, що карбонатна система і в майбутньому відіграватиме дуже істотну роль, оскільки поглинання СО2 океаном рятує нас від теплової смерті.
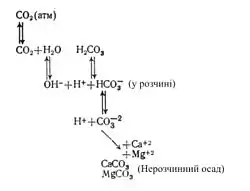
Найбільш активним компонентом карбонатної системи є діоксид вуглецю (СО2). Через діоксид вуглецю здійснюється зв'язок двох геохімічних циклів: неорганічного і органічного вуглецю. Концентрація вуглецю безперервно зменшується, починаючи від СО2 в атмосфері, через пов'язану діоксид вуглецю у водах океану і потім вуглець у складі органічних речовин. Цікаво відзначити, що концентрація закумульованого вуглецю у складі органічних речовин також безперервно зменшується через ускладнення складу органічних сполук та живих клітин. Вище за зону термоклину в поверхневому шарі океану міститься 0,20 г/см3 неорганічного вуглецю, що складає не більше 3% сумарного його вмісту, інші 7,25 г/см3 є в глибинні води. Вміст розчиненого в морській воді органічного вуглецю досягає [уточнити] г/см3, що значно більше, чим щільність вуглецю в морській біосфері (0,002 г/см3.
У морській воді вміст вільної вуглекислоти дуже невеликий і зазвичай не перевищує 2,5 мг/л. Середня концентрація СО2 у морській воді дорівнює 0,5 мл/л, тобто на порядок нижче, ніж концентрація кисню, але повний вміст СО2 в усіх формах карбонатної системи дорівнює 50 мл/л, що приблизно на порядок більше середньої концентрації кисню. Таким чином, ми бачимо, що карбонатна система залежно від умов рН і інтенсивності фотосинтезу може поставляти вуглекислоту в найширших межах.
Сума аніонів НСО3- і СО3- слабкої вугільної кислоти визначає величину карбонатної лужності, а негативний логарифм активності вільних водневих іонів (Н+) характеризує кислотні умови середовища або рН. Карбонатна лужність складає близько 95% загальної лужності морської води, решта припадає на борну, фосфорну і кремнієву кислоти. У гідрохімічних дослідженнях зазвичай оперують відношенням величин лужності (Аlк) до хлористості (Сl), для Тихого океану дорівнює, — Аlк/Сl = 0,123/0,128.
Будь-які зміни стану карбонатної системи відразу ж відбиваються в зміні рН. Поглинання СО2 з атмосфери, або виділення вуглекислоти в результаті розкладання органічної речовини, або просто в процесі дихання водних організмів призводять до пониження рН, тобто збільшення кислотності морської води. Поглинання СО2 в процесі фотосинтезу і виділення СО2 в атмосферу, наприклад, при нагріві води призводить до збільшення рН. При збільшенні тиску, рН морської води зменшується за рахунок збільшення дисоціації вугільної кислоти. Морська вода, що має на поверхні рН рівне 8,2, на глибині 5000 м матиме рН рівне 8,01, а на глибині 10 000 м — 7,82. Приблизно можна вважати, що рН морської води зменшується на 0,04 при збільшенні глибини на кожні 1000 м. Таким чином, у міру збільшення глибини у воді накопичується вуглекислота, яка створюється при при диханні і при розкладанні органічної речовини, а, крім того, збільшення дисоціації вугільної кислоти також призводить до пониження рН, тобто підкислення води. На глибинах 3000-4000 м ці процеси призводять до повного розчинення карбонатів кальцію і магнію. Глибше 4000 м карбонатних осадів в донних відкладеннях не спостерігається. На менших глибинах карбонатні осади, навпаки, найбільше поширені, а товща води пересичена відносно кальциту і арагоніту до 200–250%.
Для того, щоб наочніше уявити собі зміну форм вуглецю в системі СО2-, НСО3-, СО3- залежно від рН, можна розглянути таблицю:
| pH | CO2 | HCO2- | CO3−2 |
|---|---|---|---|
| 4,0 | 100 | 0 | 0 |
| 5,0 | 82 | 18 | 0 |
| 6,0 | 51 | 49 | 0 |
| 7,0 | 11 | 89 | 0 |
| 8,0 | 0 | 95 | 5 |
| 9,0 | 0 | 61 | 39 |
| 10,0 | 0 | 19 | 81 |
| 11,0 | 0 | 2 | 98 |
| 12,0 | 0 | 0 | 100 |
Див. також
Література
- Хільчевський В. К., Осадчий В. І., Курило С. М. Основи гідрохімії: підручник. — К.: Ніка-Центр, 2012. — 312 с.
- Никаноров А. М. Гидрохимия. СПб: Гидрометеоиздат, 2001. — 444 с.
Ресурси Інтернету
- sistema.html Карбонатная система[недоступне посилання з липня 2019]
- Основи гідрохімії
