Борна кислота
Бо́рна кислота́ (о́ртобо́рна, о́ртобора́тна, бора́тна кислота́) Н3ВО3, B(OH)3 — слабка неорганічна кислота. Білі кристали, малорозчинні у воді при кімнатній температурі і значно більше у гарячій воді. При нагріванні борна кислота втрачає воду, утворюючи спочатку метаборну кислоту (НВО2), потім тетраборну (Н2В4О7) і, нарешті, оксид бору (В2О3); при розчиненні у воді з цих сполук знову утворюється борна кислота. У природі борна кислота зустрічається у вигляді мінералу — сасоліну.
| Борна кислота | |
|---|---|
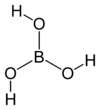 Структурна формула | |
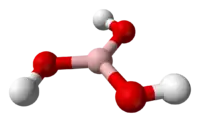 | |
 Кристали борної кислоти | |
| Назва за IUPAC | Борна кислота |
| Ідентифікатори | |
| Номер CAS | 10043-35-3 |
| PubChem | 7628 |
| Номер EINECS | 233-139-2 |
| DrugBank | 11326 |
| KEGG | D01089 |
| ChEBI | 33118 |
| RTECS | ED4550000 |
| Код ATC | S02AA03 і D08AD |
| SMILES |
B(O)(O)O |
| InChI |
1/BH3O3/c2-1(3)4/h2-4H |
| Номер Гмеліна | 1585 |
| Властивості | |
| Молекулярна формула | H3BO3 |
| Молярна маса | 61,83 г/моль |
| Зовнішній вигляд | Біла кристалічна речовина |
| Густина | 1,435 г/см3 |
| Тпл | 170,9 °C |
| Ткип | 300 °C |
| Розчинність (вода) | 2,52 г/100 мл (0 °C) 4,72 г/100 мл (20 °C) 5,7 г/100 мл (25 °C) 19,10 г/100 мл (80 °C) 27,53 г/100 мл (100 °C) |
| Кислотність (pKa) | 9,24 |
| Структура | |
| Геометрія | Рівносторонній трикутник |
| Небезпеки | |
| ЛД50 | 2660 мг/кг, орально (криса) |
| Класифікація ЄС | |
| R-фрази | R60 R61 |
| S-фрази | S53 S45 |
| NFPA 704 |
 0
2
0
|
| Температура спалаху | не запалюється |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Поширення у природі
Незв'язана кислота зустрічається в деяких вулканічних районах, таких як Тоскана, Ліпарські острови і Невада. Її також можна виявити в складі багатьох мінералів (бура, борацит і колеманіт). Наявність борної кислоти та її солей було знайдено в морській воді. Вона також знаходиться в рослинах і майже у всіх фруктах.
Отримання
Борна кислота була вперше виготовленна Вільгельмом Гомбергом (1652–1715) з бури, під дією неорганічних кислот, і було дано назву sal sedativum Hombergi («заспокійлива сіль Хомберга»).
- Na2B4O7·10H2O + 2 HCl → 4 B(OH)3 (або H3BO3) + 2 NaCl + 5 H2O
Застосування
Борна кислота широко використовується у медицині як слабкий антисептичний засіб: у вигляді 1—2%-вого водного розчину — для промивання ран та слизових оболонок статевих органів; у порошку — для лікування носа й вуха; у спиртових розчинах і мазях — для лікування шкіри. Крім того, борну кислоту застосовують для дублення шкіри, у виробництві скла, виготовленні деяких фарб та емалей.
Використання в ядерних реакторах
Борну кислоту у вигляді водного розчину використовують у ядерних реакторах з водою під тиском (водо-водяні реактори). У цьому типі реакторів водний розчин борної кислоти використовується як поглинач нейтронів внаслідок вмісту у кислоті елементу — Бору. У природі елемент бор має два ізотопи — В10 (20% вмісту) та В11 (80% вмісту). Для поглинання нейтронів використовують високий абсорбційний коефіцієнт для нейтронів ізотопу В10, що і використовують для управління ядерною реакцією та її потужністю у реакторі. При цьому проходять наступні ядерні перетворення (реакції):
Джерела
- Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985. (С.?)
Література
- Фармацевтична хімія : [арх. 11 березня 2021] : підручник / ред. П. О. Безуглий. — Вінниця : Нова Книга, 2008. — 560 с. — ISBN 978-966-382-113-9. (С.100-102)
- Фармакологія: підручник (ВНЗ І—ІІІ р. а.) / І.В. Нековаль, Т.В. Казанюк. — 7-е вид., переробл. і допов. — «Медицина», 2016 — 552 с. ISBN 978-617-505-507-6 (С.?)
