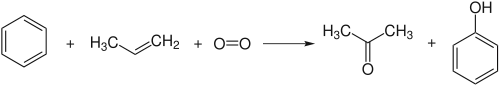Куменовий метод
Куме́новий ме́тод (кумо́льний ме́тод) — промисловий метод синтезу фенолу C6H5OH із бензену і пропілену. Метод полягає у реакції вихідних речовин із утворенням кумену (ізопропілбензену), котрий внаслідок окиснення розщеплюється на фенол та ацетон, інший промислово важливий продукт:
Вперше цей спосіб синтезу був розроблений у 1942 році в таборі ГУЛАГ латвійським хіміком Рудольфом Удрісом під керівництвом Петра Сергеєва. У західній науковій літературі метод має назву процес Хока (англ. Hock process), за ім'ям Генріха Хока, який запропонував аналогічний спосіб синтезу фенолу у 1944 році[1].
Куменовий метод є основним способом отримання фенолу у промислових масштабах — на нього припадає близько 95 % світового виробництва.
Окрім самого фенолу, за цим методом можна отримати й інші феноли, такі як нафтоли та гідрохінон.
Стадії синтезу
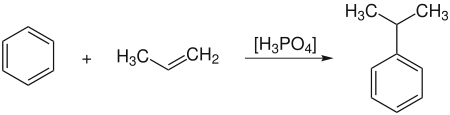
Алкілювання бензену
Сполучення бензену та пропілену відбувається за реакцією алкілювання Фріделя—Крафтса у присутності ортофосфатної кислоти:
Окиснення
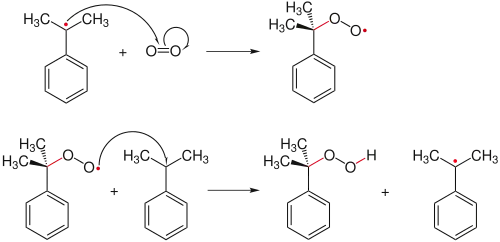
Окиснення кумену здійснюється шляхом його реакції із киснем повітря. Взаємодія проводиться у барботажному реакторі за тиску від атмосферного до 700 кПа та температури 80—120 °C. Каталізатором реакції виступають солі кобальту.
Побічними продуктами реакції окиснення є ацетофенон і диметилбензиловий спирт. Другий дегідратується на наступній стадії до альфа-метилстирену, котрий відділяється для подальшого гідрування до кумену і повертається у цикл виробництва.
До ймовірних забруднювачів гідропероксиду належать метанол і непрореагований кумен, які відокремлюються дією адсорбентів типу активованого вугілля. Концентрація отриманого на цій стадії гідропероксиду варіюється у межах 20—40 %, а за рахунок вакуумної дистиляції цей показник вдається підвищити до 65—90 %.
Розщеплення
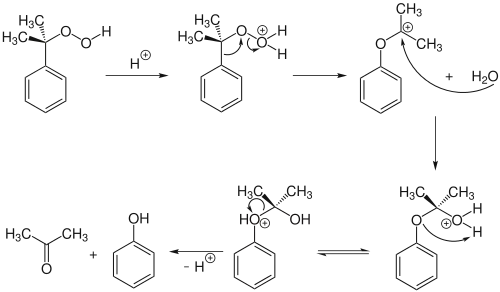
Стадія розщеплення гідропероксиду кумену проводиться за температури 100 °C у реакторах із теплообмінниками, оскільки реакція протікає дуже швидко і є сильно екзотермічною (енергетичний ефект реакції — 252 кДж/моль)
У кислому середовищі, яке створює 40 % сульфатна кислота і невелика кількість каталізатору (на рівні мільйонних масових часток), протонований гідропероксид втрачає молекулу води. Внаслідок 1,2-зсуву ця частинка перегруповується у карбокатіон, котрий приєднує втрачену молекулу води, утворюючи напівацеталь. Ацеталь розпадається у кислому середовищі на фенол та ацетон:
Разом зі стадією окиснення етап розщеплення має основне значення при оцінці ефективності виробництва. Зокрема, одному кілограму кумену, отриманому після першої стадії, відповідає близько 0,75 кг кінцевого фенолу і 0,46 кг ацетону. Вихід фенолу за двома кінцевими стадіями перевищує 98 %, а загальний вихід фенолу за цим методом сягає 96 %.
Примітки
- Hock, H., Lang, S. Autoxydation von Kohlenwasserstoffen, IX. Mitteil.: Über Peroxyde von Benzol-Derivaten // Berichte der deutschen chemischen Gesellschaft. — 1944. — Т. B77 (12 листопада). — С. 257–264. — DOI:. (нім.)
Джерела
- Wallace, J. Phenol // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Weber Manfred, Weber Markus, Kleine-Boymann, M. Phenol // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Травень В. Ф. Органическая химия. Учебник для вузов. — М. : ИКЦ «Академкнига», 2006. — Т. 2. — С. 59—60. — ISBN 5-94628-068-6. (рос.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.