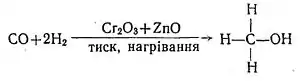Метанол
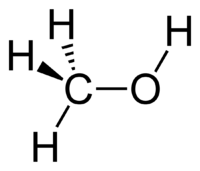
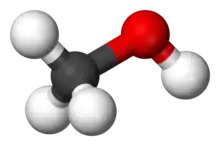
Метано́л (інші назви: метиловий спирт, карбінол, деревний спирт); формула: CH3OH — найпростіший одноатомний спирт.
| Метанол | |
|---|---|
 | |
 | |
| Назва за IUPAC | methanol |
| Інші назви | метиловий спирт карбінол деревний спирт |
| Властивості | |
| Молекулярна формула | CH3OH |
| Молярна маса | 32,04 г/моль |
| Густина | 0,7918 г/см3 |
| Тпл | −98 °C |
| Ткип | 64,5 °C |
| В'язкість | 0,5513 мПа·с при 25 °C |
| Структура | |
| Дипольний момент | 1,69 дебай |
| Небезпеки | |
| Класифікація ЄС | |
| R-фрази | R11 Шаблон:R23/24/25 Шаблон:R39/23/24/25 |
| S-фрази | (S1/2) S7 S16 S36/37 S45 |
| NFPA 704 |
 3
1
0
|
| Температура спалаху | 12 °C |
| Ідентифікатори | |
| Номер CAS | 67-56-1 |
| PubChem | 887 |
| Номер EINECS | 200-659-6 |
| KEGG | D02309 і C00132 |
| ChEBI | 17790 |
| RTECS | PC1400000 |
| SMILES |
CO[1] |
| InChI |
InChI=1S/CH4O/c1-2/h2H,1H3 |
| Номер Бельштейна | 1098229 |
| Номер Гмеліна | 449 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
За нормальних умов метанол — це прозора, безбарвна, легкозаймиста і летка рідина зі слабким спиртовим запахом. Він змішується з багатьма органічними розчинниками та необмежено змішується з водою.
Історія
Вперше метанол був виявлений в 1661 році Робертом Бойлем при вивченні продуктів перегонки дерева, проте в чистому вигляді метиловий спирт, або деревний (оскільки першим з відомих методів його отримання був метод сухої перегонки деревини), отриманий цим способом, був виділений тільки через 200 років у 1834 році Дюма і Пеліго: тоді вперше вдалося очистити його від домішок супутніх речовин, перш за все оцтової кислоти і ацетону. У 1857 році Марселен Бертло отримав метанол омиленням хлористого метилу. Процес сухої перегонки деревини довгий час залишався, мабуть, єдиним способом виробництва метанолу. Зараз він повністю витіснений каталітичним синтезом з оксиду вуглецю і водню. Отримання метанолу з синтез-газу вперше було здійснено в Німеччині в 1923 році фірмою BASF. Процес проводився під тиском 100—300 атм на оксидних цинк-хромових каталізаторах (ZnO-Cr2O3) в інтервалі температур 320—400 ºС, продуктивність першої промислової установки доходила до 20 т/добу. Цікаво, що в 1927 році в США був реалізований промисловий синтез метанолу, базований не тільки на монооксиді, а й на діоксиді вуглецю.
Сучасний метод отримання — каталітичний синтез з оксиду карбону (II) і водню (температура 250 °C, тиск 7 Мпа, каталізатор суміш оксидів цинку і купруму):
- СО + 2Н2 → CH3OH
Реакцію можуть прискорити каталізатори, такі як оксиди міді, цинку або хрому[2]. Обнадійливі результати також були отримані від використання свинцю і талію в якості каталізаторів.
Фізичні властивості
Метиловий спирт — рухлива рідина (в'язкість 0,5513 мПа·с при 25 °C) із слабким запахом, схожим на запах звичайного спирту. Густина його 0,792 г/см3. Температура кипіння 64,5°С, замерзання −98 °C.Температура самозаймання 464 °C.
З водою змішується в будь-яких співвідношеннях. Добрий розчинник для багатьох органічних речовин. Горить синюватим полум'ям. Метиловий спирт — отруйна речовина, що діє на нервову і судинну системи людини. При потраплянні в організм людини 10 мл метанолу може призвести до важкого отруєння, до сліпоти; попадання 25—30 мл метанолу призводить до смертельного випадку.
Отримання
Метиловий спирт тепер добувають синтетичним способом з монооксиду вуглецю і водню при температурі 300—400 °C і тиску 300—500 атм у присутності каталізатора — суміші оксидів хрому, цинку й ін. Сировиною для синтезу метанолу служить водяний газ (CO + H2), збагачений воднем:
Раніше метиловий спирт добували винятково з продуктів сухої перегонки деревини. Тепер цей спосіб має другорядне значення.
Метанол є одним з найтоннажніших продуктів нафтохімії. Загальносвітові потужності виробництва метанолу сягають близько 95 млн тон/рік.
Хімічні властивості
Метиловий спирт, як і інші спирти, при взаємодії з лужними металами утворює алкоголяти, наприклад метилат калію CH3OK:
- 2CH3OH + 2К → 2CH3OK + H2↑
При взаємодії з водою алкоголяти, метилового спирту, як і алкоголяти етилового спирту, легко гідролізують, утворюючи спирт і їдкий луг. Наприклад:
- CH3OK + H2O → CH3OH + KOH
При взаємодії з кислотами утворює складні ефіри. Наприклад, з нітратною кислотою утворює нітратнометиловий ефір, або метилнітрат:
У кислому середовищі також утворює диметиловий етер:
Застосування
Метиловий спирт застосовується дуже широко. Найбільша його кількість іде на виробництво формальдегіду, який використовується для виготовлення карбамідних, меламінових і фенолформальдегідних смол. Значні кількості CH3OH використовують у лакофарбовій промисловості для виготовлення розчинників при виробництві лаків. Крім того, його застосовують як добавку до рідкого палива для двигунів внутрішнього згорання.
Метанол широко застосовується в лабораторній практиці як розчинник для проведення реакцій з полярними органічними речовинами, як розчинник для хроматоргафічного розділення та як реагент для отримання метилових ефірів кислот. Метанол широко використовується як паливо для високофорсованих двигунів внутрішнього згоряння, що беруть участь у змаганнях на швидкість і стартовий розгін (драг рейсінг), а також для авіамодельних двигунів часто в суміші з нітрометаном (5—30%). Хоча метанол має в 1,9 рази меншу теплотворність, ніж бензин, зате в тій же кількості повітря можна спалити у 2,3 раза більшу кількість метанолу, ніж бензину. Це дає 20% виграш в енергії заряду, отже і в потужності двигуна. Враховуючи високе октанове число метанолу можна збільшити ступінь стиску в циліндрах двигуна до 16-20, що додасть ще потужності двигуну і зробить його економічнішим.
Останнім часом значна кількість метанолу використовується для виробництва трет-бутилметилового етеру і для переетерифікації рослинних олій у біодизель.
Примітки
- methanol
- Mälkönen, Pentti (1979). Orgaaninen kemia (Фінською мовою). Otava. ISBN 951-1-05378-7.
Посилання
Джерела
Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.