Лактатдегідрогеназа
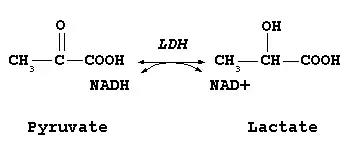
Лактатдегідрогеназа (ЛДГ або L-лактат:NAD-оксидоредуктаза (LDH) 1.1.1.27) — фермент, який бере участь в реакціях гліколізу. Молекулярна маса становить 144 кДа. Лактатдегідрогеназа каталізує перетворення пірувату у лактат, при цьому утворюється НАД. Представлений п'ятьма ізоформами.
| Лактатдегідрогеназа A (M субодиниця) | |
|---|---|
_1I10.png.webp) Людська лактатдегідрогеназа М4 (ізоформа виділена із склетених м'язів) | |
| Ідентифікатори | |
| Символ | LDHA |
| Інші символи | LDHM, ЛДГА |
| Entrez | |
| OMIM | |
| RefSeq | |
| UniProt | |
| Інша інформація | |
| Шифр КФ | |
| Локус | Хр. 11 |
| Лактатдегідрогеназа B (H субодиниця) | |
|---|---|
_1I10.png.webp) | |
| Ідентифікатори | |
| Символ | LDHB |
| Інші символи | ЛДГ D |
| Entrez | |
| HUGO | |
| OMIM | |
| RefSeq | |
| UniProt | |
| Інша інформація | |
| Шифр КФ | |
| Локус | Хр. 12 |
| Лактатдегідрогеназа C | |
|---|---|
_1I10.png.webp) | |
| Ідентифікатори | |
| Символ | LDHC |
| Інші символи | ЛДГ C |
| Entrez | |
| HUGO | |
| OMIM | |
| RefSeq | |
| UniProt | |
| Інша інформація | |
| Шифр КФ | |
| Локус | Хр. 11 |
Вперше лактатдегідрогеназа була виділена із м'язів Меєргофом в 1909 році, а в 1940 році Штрауб отримав її в кристалічному вигляді.
Лактатдегідрогеназа стійка до впливу певних хімічних факторів, наприклад до дії реактивів, що окиснюють або блокують сульфгідрильні групи, наприклад, до йодоацетату і йодобензоату. Активність лактатдегідрогенази знижується при підвищенні концентрації пірувату вище 10-4 М. Значне інгібування, оборотне при додаванні цистеїну, відбувається при інкубуванні із парахлормеркурійбензоатом.
Структура
Активною формою лактатдегідрогенази (молекулярна маса 144 кДа) є тетрамер з 4 субодиниць. Кожна субодиниця утворена пептидним ланцюгом із 334 амінокислот (36 кДа). У тетрамері субодиниці займають еквівалентні положення; кожен мономер містить активний центр.
В організмі ссавців є два різні типи субодиниць ЛДГ (H і M), вони дещо відрізняються за амінокислотною послідовністю і каталітичними властивостями, і можуть утворювати тетрамери у будь-якому співвідношенні. У міокарді містяться переважно тетрамери, що складаються із 4-ох Н-субодиниць (від англ. Heart), у печінці та скелетних м'язах переважає М4 ЛДГ.
Піридиннуклеотидні коферменти
Всі дегідрогенази потребують коферменту для перенесення відновлювальних еквівалентів. Найпоширенішими є коферменти динуклеотидного типу, в якому два нуклеозид-5'-монофосфати з'єднані фосфоангідридним зв'язком. ЛДГ і багато інших дегідрогеназ як кофермент використовують нікотинамідаденіндинуклеотид, скорочено НАД + (англ. NAD+).
В окисно-відновних реакціях за участі НАД окиснюється або відновлюється тільки нікотинамідне кільце. Під час окиснення лактату дегідрогеназа відщеплює від нього два атоми водню, тобто тобто два електрони і два протони. Однак на НАД+ переноситься тільки гідрид-іон (H-, два електрони і один протон). Акцептором гідрид-іону є атом карбону в пара-положенні до атома нітрогену нікотинамідного кільця НАД+. У цьому місці утворюється аліфатична СН2-група, перебудовуються подвійні зв'язки кільця і зникає позитивний заряд. Другий протон вивільняється в середовище і (через це відновлену форму коферменту правильніше записувати НАДН + H+). При окисненні або відновленні нікотинамідного кільця змінюються також спектральні характеристики коферменту. Тому за реакцією можна легко стежити спектрофотометричним методом.
Ізоформи ЛДГ
Ізоформи ЛДГ:
H — heart; M — muscle
