Оцтова кислота
О́цтова кислота́ — органічна сполука, одноосновна карбонова кислота складу CH3COOH. За звичайних умов є безбарвною рідиною із різким запахом. Температура плавлення чистої кислоти дещо нижча від кімнатної температури, при замерзанні вона перетворюється на безбарвні кристали — це дало їй технічне найменування льодяна оцтова кислота.
| Оцтова кислота | |
|---|---|
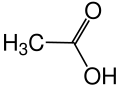 Структурна формула |
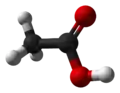 Кульково-стрижнева модель |
 Оцтова кислота в пляшці | |
| Назва за IUPAC | Оцтова кислота |
| Систематична назва | Етанова кислота |
| Інші назви | Метанкарбонова кислота, етаноатна кислота, оцет (розчин) |
| Ідентифікатори | |
| Абревіатури | AcOH, HAc |
| Номер CAS | 64-19-7 |
| PubChem | 176 |
| Номер EINECS | 200-580-7 |
| DrugBank | DB03166 |
| KEGG | D00010 |
| Назва MeSH | Acetic+acid |
| ChEBI | 15366 |
| RTECS | AF1225000 |
| Код ATC | (S02 G01 (S02 |
| SMILES |
CC(O)=O |
| InChI |
InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4) |
| Номер Бельштейна | 506007 |
| Номер Гмеліна | 1380 |
| 3DMet | B00009 |
| Властивості | |
| Молекулярна формула | CH3COOH, C2H4O2 |
| Молекулярна маса | 60,053 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Запах | оцтовий |
| Густина | 1,0446 г/см³ |
| Тпл | 16,635 °C[1] |
| Ткип | 117,87 °C[2][1] |
| Розчинність (вода) | змішується |
| Кислотність (pKa) | 4,756 |
| Діелектрична проникність (ε) | 6,20 |
| Показник заломлення (nD) | 1,3720 (20 °C) |
| В'язкість | 1,056 мПа·с |
| Дипольний момент | 1,70 D |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-484,3 кДж/моль (рід.) -432,2 кДж/моль (газ) |
| Ст. ентропія S |
159,8 Дж/(моль·K) (рід.) 283,5 Дж/(моль·K) (газ) |
| Теплоємність, c |
123,3 Дж/(моль·K) (рід.) 63,4 Дж/(моль·K) (газ) |
| Пов'язані речовини | |
| Інші (карбонові кислоти) | Мурашина кислота Пропіонова кислота |
| Пов'язані речовини | Ацетальдегід Ацетамід Оцтовий ангідрид Ацетонітрил Ацетилхлорид Етанол Етилацетат Ацетат калію Ацетат натрію Тіооцтова кислота |
| Небезпеки | |
| ЛД50 | 3,31 г/кг, орально (пацюки) |
| Індекс ЄС | 607-002-00-6 |
| Класифікація ЄС | |
| R-фрази | R10, R35 |
| S-фрази | (S1/2), S23, S26, S45 |
| NFPA 704 |
 2
3
0
|
| Температура спалаху | 39 °C |
| Температура самозаймання | 463 °C |
| Вибухові границі | 4—19,9%[2] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Назва кислоти утворена словом оцет, що походить від лат. acetum — кисле вино. За номенклатурою IUPAC вона має систематичну назву етанова кислота, котра характеризує сполуку як похідну етану. Оскільки молекула кислоти має у своєму складі функціональну групу ацетил CH3CO (умовне позначення Ac), її формула також може записуватися як AcOH. У контексті кислотно-основних взаємодій символом Ac інколи позначається ацетат-аніон CH3COO- — в такому випадку формула матиме запис HAc.
Взаємодіючи з металами, лугами та спиртами, оцтова кислота утворює ряд солей та естерів — ацетатів (етаноатів).
Оцтова кислота — один з базових продуктів промислового органічного синтезу. Більш ніж 65% світового виробництва оцтової кислоти йде на виготовлення полімерів, похідних целюлози та вінілацетату. Полівінілацетат є основою багатьох ґрунтівних покрить та фарб. З ацетатної целюлози виготовляють ацетатне волокно. Оцтова кислота та її естери важливі промислові розчинники та екстрагенти.
Загальні відомості
Оцтова кислота відома людству з прадавніх часів. Оцет, 4—12% розчин оцтової кислоти у воді, як продукт ферментації вина набув широкого використання більш ніж 5000 років тому, перш за все як харчовий консервант. Давньогрецький лікар Гіппократ використовував розчини кислоти як антисептик, а також у складі настоянок проти численних захворювань, включаючи лихоманку, запори, шлункові виразки, плеврит.[3]
Оцтова кислота міститься в низьких концентраціях у багатьох рослинних і тваринних системах. Вона, зокрема, синтезується бактеріями роду Acetobacter і Clostridium. Серед роду Acetobacter найбільш ефективним є вид Acetobacter aceti.
В 1996 році американські науковці повідомили про спостереження молекул оцтової кислоти у газопиловій хмарі Стрілець B2. Це відкриття вперше здійснено із застосуванням інтерферометричного обладнання.[4]
Фізичні властивості

Оцтова кислота за стандартного стану є безбарвною рідиною із різким запахом. При замерзанні, за температури 16,635 °С, вона перетворюється на прозорі кристали (льодяна оцтова кислота)[1].
| 25 °C | 50 °C | 75 °C | 100 °C | 110 °C |
|---|---|---|---|---|
| 1,056 | 0,786 | 0,599 | 0,464 | 0,424 |
Оцтова кислота необмежено змішується з водою, утворює значну кількість азеотропних сумішей із органічними розчинниками:
| Другий компонент | Температура кипіння, °C | Вміст кислоти, % | Вміст другого компонента, % |
|---|---|---|---|
| Гексан | 68,3 | 6,0 | 94,0 |
| Октан | 105,7 | 53,7 | 46,3 |
| Циклогексан | 78,8 | 9,6 | 90,4 |
| Бензен | 80,05 | 2,0 | 98,0 |
| Толуен | 100,6 | 28,1 | 71,9 |
| Етилбензен | 114,65 | 66 | 34 |
| Стирен | 116,8 | 85,7 | 14,3 |
| Піридин | 138,1 | 51,1 | 48,9 |
| Тетрахлорометан | 76 | 98,46 | 1,54 |
| Хлоробензен | 114,7 | 58,5 | 41,5 |
| Нітроетан | 112,4 | 30 | 70 |
Інші фізичні характеристики:
- критичний тиск 5,79 МПа;
- критична температура 321,6 °С;
- питома теплоємність 2010 Дж/(кг·K) (при 17 °С);
- поверхневий натяг 27,8·10−3 Дж/м² (при 20 °С);
- корозійна активність 10%-го водного розчину по відношенню до Ст. 3 2,97 г/(год·м²) (при 20 °С).
Отримання

Синтез розчинів оцтової кислоти (оцту) проводиться здебільшого методом ферментації, а для отримання чистої кислоти, у значних масштабах застосовуються методи карбонілювання метанолу, окиснення бутану й етаналю. Основним методом є отримання з метанолу.
Карбонілювання метанолу
Можливість отримання оцтової кислоти з метанолу була відкрита на німецькому концерні BASF у 1913 році:
У 1938 році співробітник BASF Вальтер Реппе продемонстрував ефективність використання як каталізаторів карбонілів металів VIIIB групи (група 9), зокрема, карбонілу кобальту [Co2(CO)8]. Перше повномасштабне виробництво із застосуванням кобальтового каталізатору було розгорнуто в 1960 році у Людвігсгафені, Німеччина.
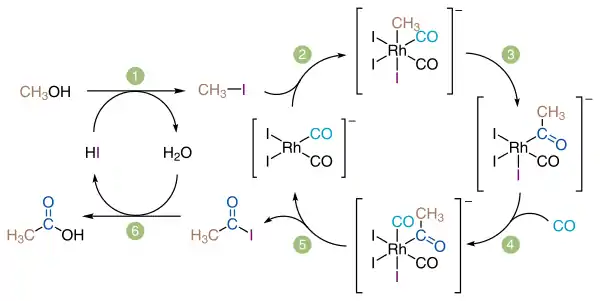
Наприкінці 1960-х у компанії «Monsanto» розробили новий тип каталізаторів на основі родію, котрі мали значно вищу активність і селективність у порівнянні з кобальтовим: навіть за атмосферного тиску вихід кінцевого продукту становив 90—99%. В 1986 році цей метод придбав «BP Chemicals» і передав його на вдосконалення компанії «Celanese».
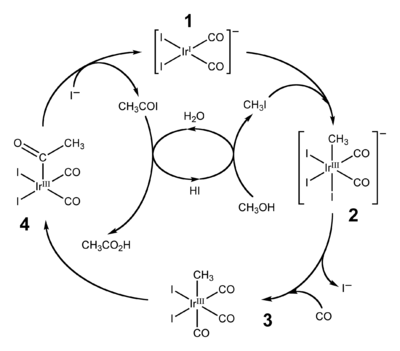
На початку 1990-х «Monsanto» запатентувала використання нового, іридієвого, каталізатора. Його перевага полягала у більшій стабільності і меншій кількості рідких побічних продуктів. «BP» придбав права на цей патент і впровадив у виробництво під назвою метод Cativa (англ. Cativa process).
Метод BASF
У виробництві за методом BASF каталізатором виступає карбоніл кобальту [Co2(CO)8], який in situ отримують з йодиду кобальту(II):
У реакційній системі утворений карбоніл активують і надалі він перебуває у вигляді комплексу [Co(CO)4]-:
На першій стадії вихідний метанол взаємодіє із йодоводнем, котрий є супутнім продуктом синтезу карбонілу, з утворенням йодометану:
Йодометан реагує із карбонілом:
Згодом проводиться карбонілювання, що веде до складного ацилкарбонільного інтермедіату:
Під дією йодид-іонів комплекс розкладається, вивільняючи каталізатор та ацетилйодид, котрий гідролізується до оцтової кислоти:
Побічними продуктами в цьому циклі є метан, етаналь, етанол, пропіонова кислота, алкільні ацетати, 2-етилбутан-1-ол. На метан перетворюється близько 2,5% метанолу, а на рідкі побічні продукти — 4,5%. 10% монооксиду вуглецю окиснюється до діоксиду:
Для реакції карбонілювання метанолу надзвичайно важливими є парціальні тиски вихідних речовин. Так, вихід кінцевого продукту сягає 70% в залежності від подачі монооксиду вуглецю та 90% в залежності від метанолу.
Метод Monsanto
За методом Monsanto каталізатором є дийододикарбонілродат [Rh(CO)2I2]-, котрий синтезують in situ з йодиду родію(III) у водному чи спиртовому середовищі.
Компанія «Celanese» вдосконалила цей метод, доповнивши його циклом оптимізації кислот, коли незначна додаткова кількість оцтової кислоти у формі ацетат-іонів подавалася на каталізатор і підвищувала його ефективність при низьких концентраціях вихідних сполук.
Синтез проводиться при температурі 150—200 °C і тиску 3,3—3,6 МПа.
Метод Cativa
Аналогічним до методу Monsanto є метод Cativa. Тут каталізатором виступає заряджений комплекс [Ir(CO)2I2]-.
У порівнянні з родієвим каталізатором, іридієвий має і переваги, і недоліки: так, окиснення іридію йодометаном відбувається у 150—200 разів швидше, але процес міграції метильної групи проходить у 105—106 разів повільніше, до того ж утворення побічного продукту метану для іридієвого каталізатора є вищим.
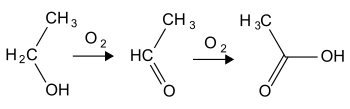
Окиснення етаналю
Прекурсором для отримання оцтової кислоти слугує етаналь, який синтезують окисненням етанолу в присутності солей срібла:
Окиснення альдегіду відбувається за радикальним механізмом із використанням ініціатора:
Реакція проходить через стадію утворення пероксоацетатного радикалу:
Отримана пероксоацетатна кислота реагує із ацетальдегідом із утворенням ацетальдегідперацетату, котрий за механізмом перегрупування Баєра — Віллігера розкладається на оцтову кислоту:
Побічним продуктом є метилформіат, котрий утворюється внаслідок міграції метильної групи.
Каталізаторами взаємодій є солі кобальту або марганцю. Вони також відіграють важливу роль у зменшенні кількості перацетат-радикалів у реакційній системі, тим самим запобігаючи утворенню вибухонебезпечних концентрацій:
Взаємодії за цим методом проводяться при температурі 60—80 °C і тиску 0,3—1,0 МПа. Перетворення альдегіду в ацетатну кислоту зазвичай відбувається із виходом понад 90% та селективністю за кислотою понад 95%.
Окиснення вуглеводнів
Оцтова кислота може бути отримана з бутану та легких фракцій нафти. Цей метод є один з найпоширеніших завдяки низькій вартості вуглеводневої сировини. У присутності металевих каталізаторів на кшталт кобальту, хрому, марганцю, бутан окиснюється повітрям:
Основними побічними продуктами є ацетальдегід і бутанон.
Ферментація
Деякі бактерії, зокрема, роди Acetobacter і Clostridium, виробляють кислоту в процесі своєї життєдіяльності. Використання людиною подібних ферментаційних процесів відоме ще з давніх-давен. Таким чином утворюється низькоконцентрована оцтова кислота, яка цілком задовольняє побутові потреби.
До ферментативного виробництва залучаються види бактерій Acetobacter aceti та штучно виведені Clostridium thermoaceticum. Для підживлення бактерій використовують цукровмісну сировину — глюкозу, ксилозу тощо:
Значною перевагою цього методу є повна екологічність виробництва.
Хімічні властивості
У газовій фазі між молекулами кислоти виникають водневі зв'язки, тому вони перебувають переважно у димерній формі (також відомі тетрамери):
Окрім цього можливе утворення гідратованого димера: молекули поєднуються між собою лише одним зв'язком, а до вільних карбоксильної та гідроксильної груп приєднуються водневими зв'язками по одній молекулі води. Ступінь перетворення на димерні структури збільшується із підвищенням концентрації розчину та знижується з підвищенням температури.
Оцтова кислота є типовою карбоновою кислотою, вона бере участь у всіх реакціях, притаманних для цього ряду сполук.
У водному розчині кислота дисоціює та віддає іон H+ молекулам води, утворюючи структуру із двома рівними зв'язками C—O:
Проявляючи кислотні властивості, оцтова кислота взаємодіє із активними металами, оксидами і гідридами металів, металоорганічними сполуками, аміаком, утворюючи ряд солей — ацетатів.
Органічні ацетати є естерами — продуктами взаємодії кислоти зі спиртами:
Конденсацією кислоти із етеном синтезують вінілацетат — промислово важливу сполуку, мономер полівінілацетату:
При дії сильних зневоднюючих агентів (типу P2O5) утворюється оцтовий ангідрид. Аналогічним є результат за участі деяких агентів хлорування (тіонілхлориду, фосгену) — тоді синтез ангідриду проходить через стадію отримання ацетилхлориду.
Пропускаючи розігріту пару кислоти над каталізатором (оксидами марганцю, торію, цирконію), можна синтезувати ацетон (із виходом близько 80%):
При нагріванні до 600 °C оцтова кислота дегідратується до кетену — етенону:
Токсичність
Перебуваючи у стані пари в повітрі, кислота пошкоджує очі, ніс та горло вже за концентрації понад 10 мг/м³. Серйозні наслідки спостерігаються при десятиденній повторюваній дії забрудненого кислотою повітря із вмістом до 26 мг/м³.
Низькоконцентровані розчини оцтової кислоти (близько 5%) можуть подразнювати слизові оболонки. Концентрована кислота значною мірою пошкоджує шкіру при контакті: у випадку її потрапляння, необхідно промити уражене місце великою кількістю води або розчину харчової соди. При проковтуванні оцтової кислоти спостерігається біль у стравоході і роті, це може призвести до появи нудоти і проблем із диханням. У цьому випадку необхідно ополоснути ротову порожнину і звернутися до лікаря.
Токсичні дози при споживанні кислоти людиною достеменно не відомі. Напівлетальною дозою для пацюків є 3310 мг/кг, для кроликів — 1200 мг/кг. Споживання людиною 89—90 г чистої кислоти є вкрай небезпечним, а граничною кількістю для щоденного споживання є 2,1 г.
Застосування
Застосування оцтової кислоти досить різноманітне. У хімічній промисловості з неї виробляють пластичні маси, різні барвники, лікарські речовини, штучне волокно (ацетатний шовк), незаймисту кіноплівку та багато інших речовин. Солі оцтової кислоти — ацетати алюмінію, хрому, феруму — застосовують як протраву при фарбуванні тканин. Оцтова кислота має широке застосування і як розчинник.
У харчовій промисловості застосовується як консервант, регулятор кислотності та смакова приправа; в Європейській системі харчових добавок оцтова кислота має код E260.[7]
Кислота застосовується при солянокислотних обробленнях привибійних зон пласта як стабілізатор (з метою стабілізації продуктів реакції) від випадання складновилучуваних гелеподібних сполук заліза (осаду). Залежно від вмісту заліза в кислотному розчині (від 0,01 до 0,5%) беруть 1—3% оцтову кислоту. Для приготування робочих розчинів використовують як синтетичну кислоту, так і лісохімічну технічну очищену.
Примітки
- Wagner Jr., Frank S. Acetic Acid // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 1. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- За тиску 101,3 кПа.
- Myers, Richard L. The 100 Most Important Chemical Compounds. — Westport, CT : Greenwood Press, 2007. — 326 p. — ISBN 978-0-313-33758-1. (англ.)
- Mehringer, David M. et al. Detection and Confirmation of Interstellar Acetic Acid // The Astrophysical Journal Letters. — 1997. — Vol. 480, iss. 1. — DOI:. Процитовано 24 травня 2015.
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Class names and the International Numbering System for food additives. codexalimentarius.org. Codex Alimentarius. Прийнято у 1989; остання правка у 2014. Процитовано 26 травня 2015.
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Wagner Jr., Frank S. Acetic Acid // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 1. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Cheung, H., Tanke, R. S., Torrence, G. P. Acetic Acid // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2007. — Т. 2 : Л — Р. — 670 с. — ISBN 57740-0828-2.
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.
Література
- Оцтова кислота. Властивості, використання, виробництво : Моногр. / Я. В. Ластов'як, Н. С. Караман, М. С. Полутаренко, Ю. А. Паздерський; Нац. ун-т "Львів. політехніка". - Л. : Вид-во Нац. ун-ту "Львів. політехніка", 2004. - 166 c. - Бібліогр.: 38 назв.