Міжгалогенні сполуки
Міжгалоге́нні сполу́ки (і́нтергалоге́нні сполу́ки, і́нтергалогені́ди) — сполуки, що складаються виключно з атомів галогенів (Флуору, Хлору, Брому, Йоду й Астату).
Прийнято вважати, що до цього ряду належать лише бінарні сполуки, та є дані і про існування сполук з трьома елементами[1][2]. Оскільки позитивними ступенями окиснення у галогенів є +1, +3, +5 і +7, склад бінарних сполук відповідає загальним формулам AB, AB3 AB5 і AB7, де B є важчим атомом.
Представники
Двоатомні сполуки
 |
 | |
Хлорид брому BrCl |
Хлорид йоду ICl |
Серед стабільних елементів (F, Cl, Br, I) існують усі 6 можливих варіацій сполук: ClF, BrF, IF, BrCl, ICl, IBr. Першим з представників був синтезований ICl — у 1813—1814 роках, незалежно Гемфрі Деві та Жозефом-Луї Гей-Люссаком.
ClF є надзвичайно стабільним, IBr і ICl є помірно стійкими і можуть бути виділені у вигляді кристалів, BrCl поступово розкладається на прості речовини, а BrF і IF швидко диспропорціонують на вищий флуорид і просту речовину (Br2 та I2 відповідно).
| ClF | BrF | IF | BrCl | ICl | IBr | |
|---|---|---|---|---|---|---|
| Вигляд[3] | Безбарвний газ | Блідо-коричневий газ | Нестабільний | Червоно-коричневий газ | Червоні кристали | Чорні кристали |
| Тпл, °C | -155,6 | прибл. -33 | — | прибл. -66 | 27,2 (α-форма) 13,9 (β-форма) | 41 |
| Ткип, °C | -100,1 | прибл. 20 | — | прибл. 5 | 97—100 | прибл. 116 |
| ΔHf298, кДж/моль | -56,5 | -58,6 | -95,4 | 14,6 | -35,3 (α-форма) | -10,5 |
Додатково, для малостабільного елементу Астату відомі двоатомні галогеніди AtCl, AtBr і AtI[4].
Чотириатомні сполуки

До існуючих чотириатомних інтергалогенідів відносяться: ClF3, BrF3, IF3, ICl3. Останній представник, хлорид йоду(III), набуває стабільності у димерній формі (I2Cl6).
| ClF3 | BrF3 | IF3 | (ICl3)2 | |
|---|---|---|---|---|
| Вигляд[3] | Безбарвний газ або рідина | Солом'яно-жовта рідина | Тверда жовта речовина | Яскраво-жовта речовина |
| Тпл, °C | -76,3 | 8,8 | — | 101 (при 16 атм) |
| Ткип, °C | 11,8 | 125,8 | — | — |
| ΔHf298, кДж/моль | -164 (газ) | -301 (рідина) | -485 (теоретично) | -89,3 |
Ряд наведених тетраатомних сполук можна доповнити сполуками IFCl2 і IF2Cl, щодо яких є дані про можливість існування[1][2].
Шестиатомні сполуки
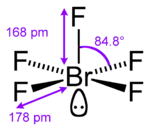
Шість атомів містять лише три міжгалогенні сполуки і всі вони є флуоридами: ClF5, BrF5, IF5.
| ClF5 | BrF5 | IF5 | |
|---|---|---|---|
| Вигляд[3] | Безбарвний газ | Безбарвна рідина | Безбарвна рідина |
| Тпл, °C | -103 | -60,5 | 9,4 |
| Ткип, °C | -13,1 | 41,3 | 104,5 |
| ΔHf298, кДж/моль | -255 (газ) | -458,6 (рідина) | -885 (рідина) |
Восьмиатомні сполуки
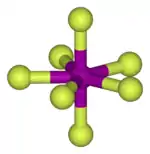
Єдиним восьмиатомним інтергалогенідом є флуорид йоду IF7.
| IF7 | |
|---|---|
| Вигляд[3] | Безбарвний газ, без. рідина, безб. тв. речовина |
| Тпл, °C | 6,5 (потрійна точка) |
| Ткип, °C | 4,8 (сублімує) |
| ΔHf298, кДж/моль | -962 |
Отримання
Міжгалогенні сполуки можна отримати прямою взаємодією простих речовин у відповідних пропорціях:
- (фтор у надлишку)
- (зріджений хлор)
- (зріджений хлор у надлишку)
- (фтор у надлишку)
Із наявних інтергалогенідів подальшим галогенуванням можна синтезувати вищі представники:
- (фтор у надлишку)
Аналогічно можливе утворення нижчих і представників:
Окремими способами є синтези вищих сполук з галогенідів металів:
Хімічні властивості
Міжгалогенні сполуки є більш реакційноздатними, аніж галогени, оскільки зв'язок між різними атомами слабший за відповідний моноатомний. Та незважаючи на це, їхні властивості значною мірою ідентичні.
Реакційна здатність найбільш активних представників інтергалогенідів знижується у ряді ClF3 > BrF3 > IF7 > BrF5 > IF5 > BrF.
Інтергалогеніди є сильними окисниками, окиснюють більшість металів, утворюючи галогенід або їхню суміш:
Реакції з оксидами (в тому числі зі складними) проходять із утворенням відповідних галогенідів і виділенням кисню:
У водних розчинах вони гідролізуються до галогенідної та оксогалогенової кислот (в залежності від ступеня окиснення):
Міжгалогенові сполуки у рідкому стані дисоціюють на катіонну і аніонну частки:
Ця властивість дає їм змогу брати участь у реакціях як у формі кислоти Льюїса, так і у формі основи:
Двоатомні міжгалогенні сполуки аналогічно до галогенів беруть у часть у реакціях приєднання за подвійними зв'язками:
Продуктом взаємодії з галогенідами металів є полігалогеніди — сполуки, де аніон складається виключно з атомів галогенів:
Застосування
Хлорид йоду ICl застосовується у визначенні йодного числа (вмісту ненасичених органічних сполук), а також як агент йодування і хлорування (в залежності від середовища). Рідкі BF3 і ClF3 використовуються для отримання флуоридів багатьох металів. Разом з ICl вони також є реагентами для отримання полігалогенідів. Флуорид BF5 є окисником палива.
Примітки
- Greenwood, Earnshaw, 1997, с. 824.
- Meyers, 2002, с. 208.
- При кімнатній температурі
- Greenwood, Earnshaw, 1997, с. 886.
Джерела
- Greenwood, N. N., Earnshaw, A. Chemistry of the Elements. — 2nd. — Oxford : Butterworth-Heinemann, 1997. — P. 824—835. — ISBN 0-7506-3365-4. (англ.)
- Saxena, P. B. Chemistry of the Interhalogen Compounds. — New Dehli : Discovery Publishing House, 2007. — P. 1—21. — ISBN 81-8356243-4. (англ.)
- Encyclopedia of Physical Science and Technology / Robert A. Meyers, editor. — 3rd. — San Diego : Academic Press, 2002. — P. 207—208. — ISBN 978-0-12-227410-7. (англ.)
- Голуб А. М. Загальна та неорганічна хімія. — К. : Видавництво Київського університету, 1968. — Т. 1. — С. 286—287.