Нітрат кальцію
Нітра́т ка́льцію, ка́льцій нітра́т (кальцієва селітра, азотнокислий кальцій, вапнякова селітра, норвезька селітра) — неорганічна сіль нітратної кислоти складу Са(NO3)2. Являє собою білі кристали, сильно гігроскопічні, які легко утворюють кристалогідрати. Для уникнення цього речовину зберігають без доступу вологи. Широко використовується як добриво, а також у виготовленні бетону і вибухівки.
| Нітрат кальцію | |
|---|---|
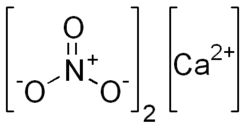 Структурна формула йонів | |
 | |
| Назва за IUPAC | Кальцій нітрат |
| Інші назви | Кальцієва селітра, нітрокальцит, норвезька селітра, вапнякова селітра |
| Ідентифікатори | |
| Номер CAS | 10124-37-5 |
| PubChem | 24963 |
| Номер EINECS | 233-332-1 |
| ChEBI | 64205 |
| RTECS | EW2985000 |
| SMILES |
[Ca+2].[O-][N+]([O-])=O.[O-][N+]([O-])=O |
| InChI |
1/Ca.2NO3/c;2*2-1(3)4/q+2;2*-1 |
| Номер Бельштейна | 3565319 |
| Властивості | |
| Молекулярна формула | Ca(NO3)2 |
| Молярна маса | 164,088 г/моль (безводний) 236,15 г/моль (тетрагідрат) |
| Зовнішній вигляд | білі кубічні кристали |
| Густина | 2,504 г/см³ (безводний) 1,896 г/см³ (тетрагідрат) |
| Тпл | 561 °C (безводний) 42,7 °C (тетрагідрат) |
| Ткип | розкладається (безводний) 132 °C (тетрагідрат) |
| Розчинність (вода) | безводний: 121,2 г/100 мл(20 °C) 271,0 г/100 мл (40° C) тетрагідрат: 102 г/100 мл (0 °C) 129 г/100 мл (20 °C) 363 г/100 мл (100 °C) |
| Розчинність | розчиняється в метанолі, етанолі та ацетоні |
| Структура | |
| Кристалічна структура | кубічна (безводний) моноклинна (тетрагідрат) |
| Небезпеки | |
| MSDS | ICSC 1037 |
| NFPA 704 |
 0
1
3
OX
|
| Температура спалаху | Не займистий |
| Пов'язані речовини | |
| Інші аніони | Нітрит кальцію Оксид кальцію |
| Інші катіони | Нітрат магнію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Нітрат кальцію є високогігроскопічною сполукою, яка може утворювати кристалогідрати, зв'язуючи до чотирьох молекул води. Якщо водний розчин нітрату кальцію упарювати до температури 40 °C, то випадатимуть кристали Ca(NO3)2·4H2O, при підвищенні температури до 45 °C виділятиметься Ca(NO3)2·3H2O, при 51 °C — Ca(NO3)2·2H2O, а вище 55 °C — безводні кристали Ca(NO3)2.
Отримання
У промислових масштабах нітрат кальцію отримують дією нітратної кислоти на вапняки:
Історично цей метод вперше застосували норвезькі промисловці, тому сполука отримала назву «норвезька селітра». Іншим методом отримання нітрату є обробка оксидом азоту(IV) деяких сполук кальцію:
Виробляють сполуку у гранульованій формі та у вигляді лусочок. З огляду на гігроскопічність нітрату, іноді, для її зменшення, Ca(NO3)2 змішують з гідрофобними добавками — 4—7% нітрату амонію NH4NO3, а також 0,5—1,0% парафінистого мазуту.
Хімічні властивості
При нагріванні не вище 500 °C нітрат кальцію розкладається на нітрит кальцію та кисень, а за температури понад 561 °C утворюється оксид кальцію:
При відновленні активним воднем, отриманим в результаті взаємодії металу з кислотою, нітрат кальцію відновлюється до нітриту:
Застосування
Ca(NO3)2 широко застосовується у сільському господарстві як нітрогеновмісне добриво. Також сполука знайшла застосування у виготовленні бетону та вибухівки.
Див. також
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Химический энциклопедический словарь / И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)