Окисно-відновні індикатори
О́кисно-відно́вні індика́тори (редо́кс-індика́тори[1]) — хімічні індикатори, що застосовуються для визначення точки еквівалентності в окисно-відновних реакціях.
Найчастіше такими індикаторами є органічні сполуки, які виявляють окисно-відновні властивості, та металоорганічні, у яких по досягненню певного потенціалу змінюється ступінь окиснення металу. В обох випадках зміни в структурі супроводжуються зміною забарвлення сполуки.
Класифікація

У залежності від типу взаємодії розрізняють індикатори:
- загальні — змінюють своє забарвлення відповідно до потенціалу та незалежно від природи речовин у розчині (наприклад, дифеніламін, метиленовий синій);
- специфічні — дають реакцію лише із певними сполуками (крохмаль є індикатором на йод, тіоціанат-іони — на катіон Fe3+).
За схемою переходу кольору індикатори поділяють на:
- однобарвні — одна форма має колір, інша — безбарвна;
- двобарвні — обидві форми мають власні кольори.
Застосовувані індикатори повинні відповідати вимогам:
- добре розчинятися у воді, кислотах та інших типових середовищах для титрування;
- бути стійкими до дії світла, повітря, інших компонентів у розчині та стабільним при тривалому зберіганні;
- забарвлення окисненої та відновленої форм має чітко відрізнятися;
- інтервал потенціалу, на якому відбувається перехід між формами, має бути вузьким і відповідати стрибку на кривій титрування;
- забарвлення повинно змінюватися швидко, а відповідна реакція бути повністю оборотною, не зазнавати впливу сторонніх реакцій;
- зміна кольору розчину в кінцевий точці титрування повинна бути чіткою навіть при найменшій кількості додаваного індикатора.
Перебіг реакції
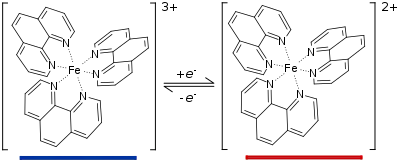
Загальною схемою дії індикатора є зворотна реакція відновлення його окисненої форми:
- Indox + ne- ⇌ Indred
Інколи взаємодія також проходить за участі іонів H+:
- Indox + ne- + xH+⇌ Indred; (x може набувати як додатних, так і від'ємних значень).
Ця реакція не впливає на поведінку індикаторів, однак спричинює додаткову витрату титранту.
У загальному вигляді потенціал індикатора, що бере участь у взаємодії, описується рівнянням Нернста:
- ,
- де E0ox/red — стандартний потенціал для даної пари форм, що відповідає умові [Indox]=[Indred]
Вважається, що перехід забарвлення помітний за десятиразового переважання однієї форми над іншою. У цьому випадку множники в рівнянні набудуть вигляду і , що дорівнює 1 та -1 відповідно. З цього припущення випливає визначення інтервалу переходу забарвлення індикатора pT:
Наприклад, дифеніламін, який має стандартний потенціал 0,76 В і здійснює перехід за участі двох електронів, змінює забарвлення в діапазоні 0,76±0,03 В. При значеннях менше 0,73 В він є безбарвним, при більших за 0,79 переважає фіолетова форма. У проміжку 0,73—0,79 В забарвлення змінюється поступово.
Похибки при використанні індикаторів
При використанні окисно-відновних індикаторів виділяється три похибки:
- хімічна — відсутність збігу кінцевої точки титрування (моменту зміни забарвлення) з реальною точкою еквівалентності. Момент зміни визначається потенціалом індикатора, на який можуть впливати pH середовища та іонна сила розчину, тому, наприклад, якщо в ході визначення сильно змінюється значення pH, момент зміни забарвлення може не збігатися зі стрибком на кривій титрування й спричинити викривлення результатів;
- візуальна — нездатність людського ока точно розрізняти зміни забарвлення;
- індикаторна — витрата додаткової кількості титранту на взаємодію з індикатором.
Поширені індикатори
| Індикатор | Колір форми | Стандартний потенціал переходу, В[2] | |
|---|---|---|---|
| Indox | Indred | ||
| Нейтральний червоний | червоний | безбарвний | 0,24 |
| Метиленовий синій | синій | безбарвний | 0,53 |
| Дифеніламін | фіолетовий | безбарвний | 0,76 |
| Дифенілбензидин | фіолетовий | безбарвний | 0,76 |
| Дифеніламінсульфокислота | червоно-фіолетовий | безбарвний | 0,85 |
| пара-Фенілантранілова кислота | червоно-фіолетовий | безбарвний | 1,08 |
| Фероїн | синій | червоний | 1,06 |
| Трис-(2,2'-дипіридилат) рутенію | безбарвний | жовтий | 1,33 |
Примітки
- Термін редокс походить від англ. redox: reduction — відновлення та oxidation — окиснення.
- При [H+] = 1 моль/л (pH = 0).
Джерела
- Пискарёва С. К. и др. Аналитическая химия. — Издание 2-е. — М. : Высшая школа, 1994. — С. 296—297. — ISBN 5-06-002179-3. (рос.)
- Аналитическая химия. Химические методы анализа / Под ред. О. М. Петрухина. — М. : Химия, 1992. — С. 289—290. — ISBN 5-7245-0640-8. (рос.)
- Жаровський Ф. Г., Пилипенко А. Т., П'ятницький І. В. Аналітична хімія. — 2-е. — К. : Вища школа, 1982. — С. 429—431.
- Бишоп, Э. Индикаторы / Пер. с англ. под ред. И. Н. Марова. — М. : Мир, 1976. — Т. 2. — С. 146—162. (рос.)
