Метали
Мета́ли (від грец. μέταλλον — «шахта», «кар'єр», «добування з надр землі»)[1] — клас хімічних елементів і речовин з такими хімічними та фізичними властивостями:
- добре проводять електричний струм і тепло,
- непрозорі, але здатні відбивати світло (мають металічний блиск),
- ковкі, що дозволяє надавати виробам з них потрібної форми та розвальцьовувати їх,
- пластичні, що дає можливість витягати їх у тонкий дріт,
- за участі у хімічних реакціях є донорами електронів (віддають електрони).





У твердому стані мають кристалічну будову (часто кубічні або гексагональні ґратки), відзначаються ковкістю. Атоми металів мають низькі енергії йонізації та малу спорідненість до електрона, отже легко втрачають електрони з утворенням катіонів. У сполуки зазвичай входять як катіони. В комплексах, де вони виступають центральними атомами, несуть позитивний заряд. Зв'язок атомів у металічних кристалах зумовлений надзвичайною рухливістю валентних електронів у кристалічних ґратках, утворених позитивними металічними йонами. В атомах металів 1 і 2 (лужні і лужноземельні метали) та 13—17 груп заповнюються s i p електронні підоболонки атомів, у металах d- та f-блоків — підоболонки d (перехідні метали) і f (лантаноїди і актиноїди). Близько 80 % хімічних елементів є металами.
Історична довідка
В стародавні часи і в середні віки вважалося, що існує лише сім металів: золото, срібло, мідь, олово, свинець, залізо, ртуть. За уявленнями алхіміків метали зароджувалися в земних надрах під впливом променів планет і поступово украй повільно удосконалювалися, перетворюючись на срібло і золото. Алхіміки вважали, що метали — речовини складні, які складаються з «металічного начала» (ртуті) і «начала горючості» (сірки). На початку 18 століття набула поширення гіпотеза, за якою метали складаються із землі і «вогняної субстанції» — флогістону.
Наприкінці 18 століття А. Л. Лавуазьє спростував гіпотезу флогістону і показав, що метали — прості речовини. У 1789 Лавуазьє у посібнику з хімії дав список простих речовин, в який включив всі відомі тоді 17 металів (Sb, Ag, As, Bi, Co, Cu, Sn, Fe, Mn, Hg, Mo, Ni, Au, Pt, Pb, W, Zn). У міру розвитку методів хімічного дослідження число відомих металів зростало. У першій половині 19 століття були відкриті елементи-супутники платини — платиноїди, отримано шляхом електролізу деякі лужні і лужноземельні метали, відкриті невідомі метали при хімічному аналізі мінералів.
У 1860-1863 роках методом спектрального аналізу були відкриті Cs, Rb, Tl, In. Відкриття радіоактивності наприкінці 19 століття дало поштовх успішним пошукам природних радіоактивних металів. І, нарешті, методом ядерних перетворень починаючи з середини 20 століття штучно отримано радіоактивні метали, зокрема, трансуранові елементи.
Цивілізаційне значення відкриття металів
Феномен відкриття металів мав визначальний вплив на життя людського суспільства, розмежувавши його розвиток на „доісторичну” (кам’яна доба) та „історичну” епохи. Видобуток руд забезпечив людство принципово новими матеріалами, які мали невідомі раніше властивості (ковкість, плавкість) та важливі переваги (здатність до зміни форми, висока міцність, експлуатаційна довговічність). Це дозволило не тільки ефективно вдосконалювати наявні знаряддя, але й створювати їх численні нові типи, що відкрило можливості для технічного прогресу. Відомий американський етнограф Г. Морган стверджував:
„Коли варвар, просуваючись крок за кроком вперед, відкрив самородні метали, почав плавити їх у тиглі й відливати в форми; коли він сплавив самородну мідь з оловом і створив бронзу й, урешті, коли ще більшим напруженням думки він винайшов горн і видобув із руди залізо – дев’ять десятих боротьби за цивілізацію було виграно”.
Моделюючи давні виробничі процеси, учені порівнювали ефективність використання кам’яних і мідних знарядь. У результаті дійшли висновку про те, що продуктивність праці підвищується. при застосуванні міді для рубання дерев – у 3 рази, для тесання – у 6–7 разів, для свердління – у 22 рази (дослідження проф. С. Семенова). Особливе значення мали металеві знаряддя праці в землеробстві, де вони значно прискорили обробку землі, збирання врожаїв, спорудження іригаційних систем.
Ще більше знадобилися властивості металів для виготовлення зброї, зокрема мечів. Виникнення воєн, підкорення племен і народів, становлення державного устрою значною мірою уможливились завдяки перевагам мідної зброї. Одним з результатів становлення гірничо-металургійного виробництва став міжнародний розподіл праці й розвиток на цій основі розгалуженої системи комунікацій давнього світу (транспортування руд, металів та виробів із них). Пошук та розробка нових родовищ сприяли міграції населення, заселенню й освоєнню віддалених земель. Помітно вплинули метали на розвиток торгівлі, оскільки були першими універсальними еквівалентами засобів торговельного обміну. Цивілізаційні зміни, викликані гірничо-металургійною діяльністю, мали глобальний характер і поєднували як технологічні, так і соціальні складові розвитку суспільства.
Класифікація металів
Металами є прості речовини більшості хімічних елементів (приблизно 80 % елементів періодичної системи елементів). Найпоширенішим хімічним елементом-металом у земній корі є алюміній.
Вміст металів у земній корі
| Метали | % маси земної кори |
|---|---|
| Алюміній | 8,8 |
| Залізо | 5,1 |
| Кальцій | 3,6 |
| Натрій | 2,6 |
| Калій | 2,6 |
| Магній | 2,1 |
| Титан | 0,6 |
| Марганець | 0,09 |
| Мідь | 0,01 |
Доля інших металів загалом не перевищує 2,0%.
Групи металів за використанням
Широко використовуються такі групи металів:
- чорні метали — залізо, манган, хром — є основними продуктами чорної металургії, а їх сплави використовують у всіх галузях машинобудування;
- дорогоцінні метали — золото, срібло і платина — використовують в ювелірній промисловості, електроніці, електротехніці, хімічній промисловості;
- важкі метали — мідь, цинк, олово і свинець — застосовують в машинобудуванні, електротехніці, енергетиці;
- легкі метали — алюміній, титан і магній — використовують як конструкційні матеріали в авіації, космічній галузі, автомобілебудуванні;
- лужні метали — калій, натрій і літій — використовують переважно у сполуках у вигляді солей та електролітів;
- лужноземельні метали — кальцій, барій і стронцій — застосовують в хімії
У техніці найбільшого застосування набули залізо, алюміній, мідь, свинець, цинк, олово, нікель. Вони ще мають назву «технічні метали».
Сплави металів
Металевими сплавами називають речовини, які складаються не менше, як з двох компонентів і одним з них обов’язково повинен бути метал. Сплави металів відіграють велику роль, оскільки зазвичай вони мають вищі функціональні (механічні, електричні, ...) і технологічні властивості, ніж їхні складові - чисті метали. Компонентами називають хімічні елементи або їх сполуки у складі сплаву. За кількістю компонентів сплави поділяють на подвійні, потрійні і т.д.
У техніці найчастіше застосовують сплави на основі заліза (чавун, сталь) і сплави кольорових металів на основі міді (латунь, бронза), алюмінію (силумін, дюралюміній), свинцю, цинку, олова, нікелю. Деякі сплави створюють на основі вольфраму, титану, ванадію, молібдену й інших металів.
Залежно від характеру взаємодії компонентів сплаву, вирізняють такі різновиди сплавів:
- механічна суміш компонентів — ці суміші неоднорідні, вони є найдрібнішою сумішшю кристалітів компонентів;
- необмежений твердий розчин компонентів — однорідний, може утворюватися за будь-якого співвідношення компонентів;
- обмежений твердий розчин компонентів — однорідний, зазвичай може утворюватися, якщо склад сплаву є близьким до одного з чистих компонентів або до певної хімічної сполуки компонентів;
- хімічна сполука компонентів — однорідний, може утворюватися за чітко визначеного співвідношення компонентів.
У твердих розчинах атоми розчиненої речовини заміщують атоми розчинника у кристалічній ґратці або проникають у неї; хімічні сполуки утворюють нову відмінну кристалічну ґратку. Після кристалізації сплаву утворюється або одна фаза (твердий розчин, хімічна сполука), або сплав, який містить суміш фаз. Фазою називають однорідну частину системи, відділену від інших складових (фаз) поверхнею поділу.
У суміші певного складу (евтектика) компоненти кристалізуються одночасно, причому температура кристалізації такого сплаву мінімальна. У неевтектичних сплавах двох компонентів, що не розчиняються один в одному і не утворюють хімічних сполук, відбувається розділення сплаву на дві фази, спочатку з розплаву виділяються кристали надлишкового, порівняно з евтектикою, компоненту, тоді температура розплаву знижується, а склад рідкої фази наближається до евтектики, кристалізація якої, нарешті, відбувається при сталій температурі. Таким чином утворюється двофазний сплав.
Сплави речовин, необмежено розчинних одна в одній у твердому стані (наприклад, золото—срібло), евтектики не утворюють. Хоча спочатку з розплаву виділяються кристали більш тугоплавкого елементу (золота) при повільному остиганні вони розчиняються у сріблі (відбувається дифузія), і сплав виходить однорідним. Швидким охолодженням, однак, можна добути сплав, що міститиме кристали різного складу.
Будова
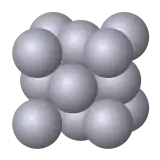

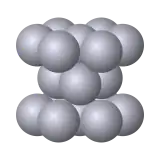
Всі метали мають кристалічну будову. Розташовані тим або іншим способом атоми утворюють елементарну комірку просторової кристалічної ґратки. Тип ґратки залежить від хімічної природи і фазового стану металу.
Залізо, хром, молібден, вольфрам і деяких інші метали мають елементарну комірку у вигляді куба із атомами у вершинах і додатковим — у центрі (об'ємноцентрована кубічна ґратка). За температури понад 910°С у кристалічній структурі заліза відбувається перебудова, кількість атомів у елементарній комірці збільшується до 14. У результаті перебудови симетрія елементарної комірки змінюється — атоми розміщуються у вершинах куба й додатково в центрі кожної грані (гранецентрована кубічна ґратка). Існування одного металу в декількох кристалічних формах зветься поліморфізмом чи алотропією, а температура, за якої метал переходить з одного стану в інший, - температурою поліморфного перетворення. Залізо, наприклад, має дві температури поліморфного перетворення: 910 °C і 1400 °C. Цинк, магній, титан мають елементарну комірку в формі шестигранної призми. Як і залізо, олово, нікель, титан, кобальт та деякі інші метали зі зміною температури змінюють тип своїх ґраток. Наприклад, нікель може мати кубічну гранецентровану чи гексагональну ґратки, а кальцій — кубічну гранецентровану, гексагональну і кубічну об'ємно-центровану.
Елементарні комірки кожного даного кристала однаково орієнтовані в просторі; розташовуючись послідовно, вони мають спільні з сусідніми комірками атоми й утворюють разом просторову ґратку. Проте різні метали з ідентичною кристалічною ґраткою мають різні параметри, тобто відстані між сусідніми атомами. Параметр решітки (сторона куба або шестигранника) у міді 0,36 нм, в алюмінію 0,405 нм, у цинку 0,267 нм тощо.
Перехід з рідкого стану у твердий для металів — це процес перетворення невпорядкованого розташування атомів у закономірне з утворенням кристалічних ґраток і, отже, кристалів. Такий процес називається первинною кристалізацією.
Установлено, що кристалізація складається з двох елементарних процесів, перебіг яких відбувається одночасно: перший — зародження центрів кристалізації, другий — ріст кристалів з цих центрів. У звичайних умовах кристали не можуть набути правильної форми тому, що їхній ріст обмежується суміжними кристалами. Кристали, що мають неправильні зовнішні обриси, називаються кристалітами або зернами. Внутрішня будова зерен кристалічна.
Важливий вплив на швидкість кристалізації та форму кристалів у процесі затвердіння металу чинять швидкість і напрям відведення тепла. У напрямку відведення тепла кристали ростуть швидше, утворюючи осі, від яких відгалужуються численні відростки. Такі деревоподібні кристали називають дендритами. Дендритна будова характерна для литого металу.
Властивості
Вимоги до металів та їх сплавів ставляться в залежності від їхнього призначення. Наприклад, метал рейок і бандажів повинен бути міцним і стійким проти зносу, метал ресор — пружним, метал заклепок — пластичним, метал електричних проводок повинен мати малий електричний опір, метал зварних конструкцій добре зварюватися і не гартуватися при охолодження на повітрі, а метал деталей, що працюють в агресивних середовищах, бути стійким до корозії.
Область застосування металів визначається їх властивостями. Властивості металів поділяють на:
- механічні (ударна в'язкість, пружність, пластичність, міцність і твердість металу);
- технологічні (фізична і технологічна зварюваність, зносостійкість, ковкість, оброблюваність різанням, ливарні властивості, здатність до паяння тощо);
- фізичні (колір, питома маса, теплова і електрична провідність, магнітні якості, температура плавлення, температурний коефіцієнт лінійного розширення тощо);
- хімічні (стійкість проти корозії, жароміцність, жаротривкість)
Механічні та фізичні властивості
Основні фізичні і механічні властивості найпоширеніших металів приведені в таблиці.
| Метали | Густина, ρ, кг/м3 | Температура плавлення, °C | Температура кипіння, °C | Границя міцності, σв, МПа | Відносне видовження, δ, % | Твердість, HB | Лінійний коефіцієнт теплового розширення, α, при 20 °C (10−6/°C) |
|---|---|---|---|---|---|---|---|
| Залізо | 7860 | 1539 | 2380 | 300 | 21...55 | 50...70 | 11,5 |
| Алюміній | 2700 | 660 | 2500 | 80...110 | 40 | 20...30 | 23,1 |
| Мідь | 8930 | 1083 | 2600 | 220 | 60 | 35 | 16,5 |
| Магній | 1740 | 651 | 1103 | 170...200 | 10...12 | 25...30 | 25,7 |
| Нікель | 8900 | 1455 | 3080 | 400...500 | 40 | 60 | 13,9 |
| Титан | 4500 | 1665 | 3260 | 300...550 | 20...30 | 100 | 1,2 |
| Молібден | 10200 | 2620 | 4800 | 800...1200 | 46 | 150...160 | 5,8...6,2 |
Усі метали (за винятком ртуті) за звичайних умов є кристалічними речовинами. Їхні атоми розташовані в певному геометричному порядку і утворюють просторову кристалічну ґратку. У вузлах кристалічної ґратки містяться іони металів. Валентні електрони дуже слабо зв'язані з атомами і можуть легко рухатися по всьому об'єму металу, переходячи від одних іонів до інших.
Легкою рухливістю валентних електронів пояснюється висока електропровідність і теплопровідність металів. На відміну від розчинів і розплавів при проходженні електричного струму через металічний провідник переносу частинок речовини не відбувається. Метали мають електронну електропровідність. За електропровідністю і теплопровідністю метали розміщуються в однаковому порядку. Найкращими провідниками електричного струму є срібло, мідь, золото і алюміній.
Характерна особливість металів — металічний блиск, тобто здатність добре відбивати світло. Але ця здатність проявляється лише тоді, коли метал утворює суцільну і гладку (поліровану) поверхню.
Дуже важливою властивістю більшості металів є пластичність, тобто здатність змінювати зовнішню форму за дії сторонньої сили і зберігати набуту форму після припинення впливу зовнішньої дії. На цій здатності базуються різні способи механічної обробки металів: вальцювання, кування, штампування, волочіння тощо. Однак ця властивість у різних металів виявляється неоднаково. Здатність розкатуватись у тоненькі листи і витягуватись у тоненький дріт найкраще виявляється у золота, срібла, міді, алюмінію і олова, трохи гірше в заліза і цинку. Деякі метали зовсім не виявляють пластичності, вони дуже крихкі — це бісмут, манган і особливо стибій (сурма). При ударі вони розпадаються на шматочки.
За густиною метали умовно поділяють на легкі (густина яких до 5 г/см3) і важкі (густина яких понад 5 г/см3). До найлегших металів належать літій, калій і натрій. Легкі метали — манган, алюміній і титан. Найважчими вважаються ртуть, золото, платина і осмій.
За твердістю метали теж дуже відрізняються один від одного. Найтвердішим металом є хром, який дряпає скло. За ним іде вольфрам, нікель тощо. До найм'якших металів належать калій і натрій, які легко ріжуться ножем. Дуже м'яким є також свинець. (Див. таблиця густин речовин; таблиця відносної твердості речовин)
За температурами плавлення метали теж різко відрізняються один від одного. Найнижчу температуру плавлення має ртуть (—39°С), за нею йде цезій (28,5 °C), рубідій (38,5 °C), калій (62,3 °C), а найвищу — вольфрам (3410 °C). (Див. таблиця температур плавлення речовин)
За забарвленням метали умовно поділяють на чорні — залізо, манган та їх численні сплави (чавун, сталь) і кольорові, до яких відносять усі інші метали. Відповідно до цього і промисловість, яка їх добуває, називають чорною і кольоровою металургією.
Хімічні властивості
Характерною особливістю металів є здатність їх атомів віддавати свої валентні електрони і утворювати позитивно заряджені іони. На відміну від неметалів метали негативно заряджених іонів не утворюють. Отже, вільні метали є відновниками. Чим легше даний метал віддає свої валентні електрони, тим він активніший відновник. За хімічною активністю метали можна розподілити на три групи: високоактивні — калій, натрій, барій, кальцій і ін., середньої активності — цинк, залізо, нікель тощо і малоактивні — срібло, золото і платина. Відносну активність металів можна визначити за положенням елемента в періодичній системі Д. І. Менделєєва: металічний характер елементів і хімічна активність металів посилюється в періодах справа наліво, а в головних підгрупах - згори донизу. Типові металічні елементи перебувають у лівому нижньому куті довгого варіанта періодичної системи. Це францій, цезій, радій.
Високоактивні метали з киснем повітря енергійно взаємодіють вже за звичайної температури, утворюючи оксиди, наприклад:
- 2Ca + O2 = 2CaO
Тому лужні і лужноземельні метали зберігають під шаром гасу, щоб запобігти їх окисненню киснем повітря. Метали середньої активності окиснюються киснем повітря лише з поверхні, покриваючись тонкою оксидною плівкою, яка запобігає дальшому окисненню металу. Наприклад:
- 2Zn + O2 = 2ZnO
Але за високої температури вони енергійно взаємодіють з киснем і перетворюються в оксиди.
Малоактивні (благородні) метали з киснем безпосередньо не реагують взагалі. Більшість металів може безпосередньо реагувати з сіркою, хлором та майже усіма неметалами, особливо за високої температури. З водою сильно активні (лужні і лужноземельні) метали взаємодіють вже за звичайної температури з виділенням водню і утворенням розчинних гідроксидів (лугів), наприклад:
- 2Na + 2H2O = 2NaOH + H2 ↑
- Ba + 2H2O = Ba(OH)2 + H2 ↑
Метали середньої активності, наприклад залізо, реагують з водою (водяною парою) лише за сильного розжарення:
- 3Fe + 4H2O = Fe3O4 + 4H2 ↑
Малоактивні метали з водою не реагують ні за яких умов. Відношення металів до кислот визначається їх місцем в електрохімічному ряду напруг (ряду активності). Усі метали, що займають місце в ряду напруг лівіше від водню, взаємодіють з кислотами з утворенням солей і виділенням водню (з нітратної кислоти водень не виділяється!) Метали, що займають місце в ряду напруг правіше від водню, водню з кислот не витісняють. Але деякі з них можуть реагувати з концентрованою сульфатною кислотою за нагрівання з утворенням солі і виділенням діоксиду сірки SO2, наприклад:
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2 ↑
Що ж стосується нітратної кислоти, то за взаємодії її з усіма металами незалежно від їх місця в ряду напруг водень з HNO3 не виділяється, а утворюються оксиди азоту і сіль металу. Наприклад:
- 3Zn + 2HNO3 + 6HNO3 = 3Zn(NO3)2 + 2NO ↑ + 4H2O
- Ag + 2HNO3 (конц.) = AgNO3 + NO2↑ + H2O
Метали в природі
Метали складають понад 80% усіх хімічних елементів. Переважна більшість металів зустрічається в природі у вигляді різних сполук і лише деякі з них — у вільному стані. Це так звані самородні метали (золото і платина), а також інколи срібло, ртуть, мідь та інші метали.
Мінерали і гірські породи, придатні для добування з них металів заводським способом, називаються рудами. Важливішими рудами є оксиди (Fe2O3, Fe3O4, Al2O3 • nH2O, MnO2 тощо); сульфіди (ZnS, PbS, Cu2S, HgS і ін.), солі (NaCl, KCl, MgCl2 CaCO3 і т. д.). Малоактивні метали зустрічаються переважно у вигляді оксидів і сульфідів, а активні (лужні і лужноземельні) — винятково у вигляді солей.
Одержання металів з руд
В більшості випадків руди містять різні домішки у вигляді піску, глини, вапняку тощо. Ці домішки називають пустою породою. Коли в руді багато пустої породи, тобто коли руда є бідною на корисну речовину, таку руду піддають збагаченню, тобто видаляють з неї частину пустої породи. Різні руди збагачують різними способами.
Для збагачення сульфідних руд звичайно застосовують спосіб флотації (спливання). При цьому способі руду розмелюють у тонкий порошок і заливають у великих чанах водою. До води додають певні органічні речовини (наприклад, соснове масло, вищі жирні кислоти тощо), молекули яких добре адсорбуються частинками сульфідів, і вкривають їх тонкою плівкою, внаслідок чого вони не змочуються водою. Крізь воду продувають повітря, пухирці якого з маслом утворюють піну, а також прилипають до частинок сульфідів, і вони спливають та збираються зверху разом з піною, а змочені водою частинки пустої породи осідають на дно (див. мал. Схема флотаційного апарату). Піну з сульфідами металів зливають з чана і віджимають сульфіди. Так одержують збагачену на корисну речовину руду.

Вільні метали добувають з руд різними способами. З оксидних руд метали одержують відновленням їх за високих температур. При цьому як відновник частіше всього використовують вугілля (кокс) і монооксид вуглецю СО. Наприклад:
- Fe2O3 + 3C = 2Fe + 3CO ↑
- Fe2O3 + 3CO = 2Fe + 3CO2 ↑
- SnO2 + C = Sn + CO2 ↑
- 2Cu2O + C = 4Cu + CO2 ↑
Інколи відновником служать активні метали. Наприклад, при добуванні хрому, берилію, мангану та інших як відновник застосовують алюміній (алюмінотермія):
- Cr2O3 + 2Al = 2Cr + Al2O3
- 3MnO2 + 4Al = 3Mn + 2Al2O3
У деяких випадках як відновник використовують водень, зокрема, при добуванні молібдену, вольфраму, порошкоподібного заліза тощо:
- Fe2O3 + 3H2 = 2Fe + 3H2O
- WO3 + 3H2 = W + 3H2O
Сульфідні руди спочатку обпалюють, переводячи їх в оксиди металів, які потім відновлюють. Наприклад:
- 2PbS + 3O2 = 2PbO + 2SO2 ↑
- PbO + C = Pb + CO ↑
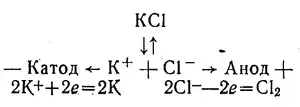
Найактивніші метали — калій, натрій, кальцій та інші — не можна одержати способом хімічного відновлення їх сполук. Ці метали одержують лише електролізом їх розплавлених солей. Наприклад:
Застосування металів
Конструкційні матеріали
Метали і їх сплави — одні з головних конструкційних матеріалів сучасної цивілізації. Це визначається насамперед їх високими міцністю, жорсткістю та іншими механічними властивостями, технологічністю у переробці, відносною доступністю, однорідністю і непроникністю для рідин і газів, стійкістю до температурних впливів та впливів навколишнього середовища. Крім того, змінюючи рецептуру сплавів, можна впливати на їх властивості у потрібному напрямку і в дуже широких межах.
Електротехнічні матеріали
Метали та сплави використовуються як хороші провідники електрики (мідь, алюміній), так і як матеріали з підвищеним опором, котрі працюють за високих температур: для виготовлення резисторів, реостатів та електронагрівальних елементів (ніхром тощо)
Інструментальні матеріали
Метали і їх сплави широко застосовуються для виготовлення інструментів (їх робочої частини). В основному це інструментальні сталі і тверді сплави.
Науки, що вивчають метали
Фізика металів (металофізика) — розділ фізики, який вивчає атомно-кристалічну, дефектну і гетерофазну структури металів і сплавів, їх фізико-хімічні властивості. Вивчає також процеси, що мають місце у металах і сплавах за їх отримання, механічної і термічної обробки та в різних умовах експлуатації. Металофізика є теоретичною основою металознавства.
Металознавство — наука, що вивчає взаємозв'язки складу, будови та властивостей металів і сплавів, а також закономірності їх зміни при теплових, механічних, фізико-хімічних та інших видах впливу. Металознавство є науковою основою пошуку складу, способів отримання і обробки металевих матеріалів з різноманітними механічними, фізичними і хімічними властивостями.
Див. також
- Неметали
- Металоїди, Напівметали
- Корозія металів
- Сплави металів
- Металічні корисні копалини
- Самородні метали
- Молекулярний метал
- Основні етапи освоєння перших металів
- Фізика металів
- Кафедра фізики металів фізичного факультету КНУ ім. Тараса Шевченка
- Кафедра фізики металів фізичного факультету ЛНУ ім. Івана Франка
- Інститут металофізики НАН України
- Активний метал
- Пасивований метал
Література
- Булатна сталь. Індія, Росія, Україна / В. Р. Назаренко. – К. ; Черкаси : [Інлес], 2013. – 436 с. – ISBN 966-7245-09-8
- Вплив газів на структуру та властивості металів і сплавів : навч. посіб. / Ю. М. Помарін, О. М. Бялік, Г. М. Григоренко; Нац. техн. ун-т України "Київ. політехн. ін-т". - К., 2007. - 128 c.
- Деркач Ф. А. Хімія. - Л., 1968.
- Дивосвіт металів / С. Є. Кондратюк, О. Л. Геллер ; НАН України, Фіз.-технол. ін-т металів та сплавів. – Київ : Академперіодика, 2015. – 204 с. : іл. – Бібліогр.: с. 202 (15 назв). – ISBN 978-966-360-303-2
- Елементарний вступ до фізичної статистики (зокрема до теорії металів) / К. Дарроу ; пер. з нім. вид. І. В. Радченко ; за ред. Б. Н., Фінкельштейна. – Х. ; К. : ОНТИ НКТП, 1934. – 96 с.
- Коллоидные металлы и металлополимеры / Э. М. Натансон, З. Р. Ульберг. – К. : Наук. думка, 1971. – 348 с.
- Металознавство і термічна обробка зварних з'єднань : Підруч. для студ. вищ. навч. закл. зварюв. спец. / М. Г. Єфіменко, Н. О. Радзівілова. - Х., 2003. - 488 c.
- Металознавство : Підруч. для студ. вузів / О. М. Бялік, В. С. Черненко, В. М. Писаренко, Ю. Н. Москаленко. - К. : "Політехніка", 2001. - 374 c.
- Металознавство та обробка металів : наук.-техн. журн. - К. - Видається з 1995. [2]
- Металознавство та термічна обробка металів : наук. та інформ. журн. - Дніпро. - Видається з 1997. [3]
- Металознавство та термічна обробка металів : Підруч. для студ. вищ. навч. закл. / О. А. Кузін, Р. А. Яцюк; Нац. ун-т "Львів. політехніка". - Л. : Афіша, 2002. - 304 c.
- Металознавство та термічна обробка чорних та кольорових металів : підручник / Б. П. Середа; Запоріз. держ. інж. акад. - Запоріжжя, 2008. - 302 c.
- Металознавство : Тлумач. слов. / М. А. Сологуб; Нац. ун-т харч. технологій. - К., 2006. - 160 c.
- Механіка руйнування та довговічність металевих матеріалів у водневмісних середовищах / О. Є. Андрейків, О. В. Гембара ; ред. І. Л. Абрам'юк. – К. : Наук. думка, 2008. – 345 с. – ISBN 978-966-00-0685-0
- Микромеханические исследования свойств металлов и сплавов / Г. Г. Максимович ; отв. ред. В. В. Панасюк. – К. : Наук. думка, 1974. – 243 с.
- Модельні методи у фізиці металів : монографія / П. М. Якібчук, В. Т. Швець ; Львів. нац. ун-т ім. Івана Франка. - Л. : ЛНУ імені Івана Франка, 2012. - 650 с. - Бібліогр. в кінці розд. - 300 экз. - ISBN 978-966-613-960-6
- Неметаллические включения и усталость стали / А. Б. Куслицкий. – К. : Техніка, 1976. – 126 с.
- Оповідання про метали / С. Й. Венецький ; скор. пер. з рос. Л. П. Яворовської. – К. : Техніка, 1972. – 128 с.
- Станіди рідкісноземельних та перехідних металів : монографія / В. В. Ромака, Л. П. Ромака, В. Я. Крайовський, Ю. В. Стадник ; М-во освіти і науки України, Нац. ун-т "Львів. політехніка". – Львів : Вид-во Львів. політехніки, 2015. – 224 с. : іл. – Бібліогр.: с. 197-221 (262 назви). – ISBN 978-617-607-816-6
- Старение металлических сплавов / К. В. Чуистов. – К. : Наук. думка, 1985. – 232 с.
- Сучасні уявлення про природу металів / А. А. Смирнов. – К. : Знання, 1966. – 54 с.
- Физика металлов / М. В. Белоус, М. П. Браун. – К. : Вища школа, 1986. – 343 с.
- Фізика невпорядкованих металів / В. Т. Швець. - О. : Маяк, 2007. - 512 c. - Бібліогр.: с. 498-509. - ISBN 966-587-163-6
Примітки
- μέταλλον Henry George Liddell, Robert Scott, A Greek-English Lexicon, on Perseus Digital Library
- Архів номерів
- Архів номерів
Посилання
- Легкі метали // Термінологічний словник-довідник з будівництва та архітектури / Р. А. Шмиг, В. М. Боярчук, І. М. Добрянський, В. М. Барабаш ; за заг. ред. Р. А. Шмига. — Львів, 2010. — С. 116. — ISBN 978-966-7407-83-4.
- Металь // Українська мала енциклопедія : 16 кн. : у 8 т. / проф. Є. Онацький. — Буенос-Айрес, 1961. — Т. 4, кн. VIII : Літери Ме — На. — С. 965-966. — 1000 екз.
- Фізика металів // Сайт Віктора Присяжнюка.
- Наукова школа «Металознавство та термічна обробка металів»
