Дифеніламін
Дифеніламін (англ. Diphenylamine) — органічна сполука з базовою формулою (C6H5)2NH. Є похідним аніліну, що складається з аміну, пов'язаного з двома фенільними групами. Сполука становить собою безбарвну тверду речовину, але комерційні зразки часто жовті через окислені домішки.[4] Дифеніламін добре розчиняється в багатьох звичайних органічних розчинниках і помірно розчиняється у воді.[5] Застосовується в основному завдяки своїм антиоксидантним властивостям. Дифеніламін широко використовується як промисловий антиоксидант, фарбувальний протруйник та реагент, а також використовується у сільському господарстві як фунгіцид та протиглисний засіб.[6]
| Дифеніламін | |
|---|---|
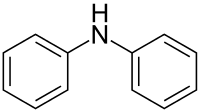 Структурна формула | |
 Кулько-паличкова модель | |
| Інші назви | (Дифеніл)амін Дифенілазан N-Фенілбензоламін Анілінобензен (Феніламіно)бензен N,N-Дифеніламін C.I. 10355 Фенілбензенамін |
| Ідентифікатори | |
| Абревіатури | DPA |
| Номер CAS | 122-39-4 |
| PubChem | 11487 |
| Номер EINECS | 204-539-4 |
| KEGG | C11016 |
| ChEBI | 4640 |
| RTECS | JJ7800000 |
| SMILES |
c1ccc(cc1)Nc2ccccc2 |
| InChI |
1/C12H11N/c1-3-7-11(8-4-1)13-12-9-5-2-6-10-12/h1-10,13H |
| Номер Бельштейна | 508755 |
| Номер Гмеліна | 67833 |
| Властивості | |
| Молекулярна формула | C12H11N |
| Молярна маса | 169,23 г/моль |
| Зовнішній вигляд | Білий, безбарвний[1] |
| Запах | приємний, рослинний[2] |
| Густина | 1,2 г/см3 |
| Тпл | 53 |
| Розчинність (вода) | 0.03%[2] |
| Тиск насиченої пари | 1 мм рт. ст. (108 °C)[2] |
| Кислотність (pKa) | 0.79[3] |
| Небезпеки | |
| ГДК (США) | none[2] |
| ГГС піктограми |     |
| ГГС формулювання небезпек | 301, 311, 319, 331, 373, 400, 410 |
| ГГС запобіжних заходів | 260, 261, 264, 270, 271, 273, 280, 301+310, 302+352, 304+340, 305+351+338, 311, 312, 314, 321, 322, 330, 337+313, 361, 363, 391, 403+233, 405, 501 |
| Головні небезпеки | Токсичний. Ймовірний мутаген. Ймовірний тератоген. Шкідливий при контакті зі шкірою, при ковтанні та вдиху. Подразник. |
| NFPA 704 |
 1
3
0
|
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Дифеніламін має вигляд безбарвних кристалів, що темніють на світлі.
Температура плавлення 54-55 °C, температура кипіння 302 °C, температура займання 153 °C, температура самозаймання 633 °C[7].
Питома теплоємність становить 1,412 Дж / (г * К) рКа 0,9 (25 °C, вода).
Легко розчинний у діетиловому етері, бензолі, ацетоні, чотирихлористому вуглеці. Розчинність при 25 °C в 100 г етанолу — 44 г, метанолу — 57,5 г, води — 0,03 м[7].
Отримання та реакційна здатність
Дифеніламін отримують шляхом термічного дезамінування аніліну над оксидними каталізаторами :
- 2 C6H5NH2 → (C6H5)2NH + NH3
Це слабка основа, з Kb 10−14. Із сильними кислотами утворює солі. Наприклад, обробка сірчаною кислотою дає бісульфат [(C6H5)2NH2 ] + [HSO4 ]- у вигляді білого або жовтуватого порошку з т. пл. 123-125 °С[8]
Дифеніламін зазнає різних реакцій циклізації. Із сіркою він дає фенотіазин, прекурсор для фармацевтичних препаратів.[9]
- (C6H5)2NH + 2 S → S(C6H4)2NH + H2S
З йодом він піддається дегідруванню з отриманням карбазолу з виділенням йодистого водню:
- (C6H5)2NH + I2 → (C6H4)2 NH + 2 HI
Арилювання з йодбензолом дає трифеніламін.[10] Також використовується як тест-реагент у тесті Діше.
Застосування
Сповільнювач гниття яблук
Дифеніламін використовується як сповільнювач поверхневого гниття до або після збору яблук, які для цього обробляють у приміщенні. Його антигнильна дія є результатом антиоксидантних властивостей, які захищають шкірку яблук від продуктів окислення α-фарнезену під час зберігання.[11] Поверхневе гниття — це фізичне пошкодження, яке проявляється в коричневих плямах після вилучення фруктів із холодильника.
Стабілізатор для бездимного пороху
При виробництві бездимного пороху дифеніламін зазвичай використовується як стабілізатор[12], таким чином аналіз залишків пострілів має на меті кількісно визначити сліди дифеніламіну.[13] Дифеніламін функціонує шляхом зв'язування продуктів розпаду нітроцелюлози (наприклад, NO, NO2 та азотної кислоти), запобігаючи прискореній деградації цих продуктів розпаду.[14]
Антиоксидант
Алкільовані дифеніламіни виконують функцію антиоксидантів у мастильних матеріалах[15] дозволених для використання в машинах, у яких не виключається контакт з їжею.[16] Алкільовані дифеніламіни та інші похідні використовуються як антиозонанти у виробництві гумових виробів, що відображає антиоксидантну природу похідних аніліну.[4]
Відновний індикатор
Багато похідних дифеніламіну використовуються як окислювально-відновлювальні індикатори, що особливо корисно при лужному окислювально-відновному титруванні.[17] Дифеніламінсульфонова кислота є простим прототипом окисно-відновного індикатора завдяки покращеній розчинності у воді порівняно з дифеніламіном.[18] Були зроблені спроби пояснити зміни кольору, пов'язані з окисленням дифеніламіну.[19][20]
У відповідному застосуванні дифеніламін окислюється нітратом для отримання синього забарвлення у дифеніламіновому тесті на нітрати.
Барвники
Кілька азобарвників, таких як метаніловий жовтий, дисперсний оранжевий 1 та кислотний оранжевий 5, є похідними дифеніламіну.
Токсичність
В експериментах на тваринах дифеніламін швидко та повністю засвоювався після прийому всередину через рот. Він зазнавав метаболізму до сульфонільних та глюкуронільних кон'югатів і швидко виводився переважно із сечею. Гостра пероральна та шкірна токсичність були низькими. Дифеніламін може викликати сильне подразнення очей. Він не викликав подразнення шкіри, і технічно не було можливою перевірити дослідження гострої токсичності шляхом вдихання. Дифеніламін націлений на систему еритроцитів і може спричинити аномальний еритропоез у селезінці, а отже — застій селезінки та гемосидероз. Зміни в печінці та нирках були виявлені при більш тривалому впливі.[5] При чітких токсичних дозах батьківських репродуктивних ефектів було обмежено зменшення місць імплантації у самок F1, пов'язане зі зменшенням розміру приплоду щурів, що вказує на можливий мутагенний або тератогенний ефект. Ніякого впливу на розвиток неможливо виділити. Американський інститут NIOSH перелічує такі симптоми отруєння: подразнення очей, шкіри, слизової оболонки; екзема; тахікардія, гіпертонія; кашель, чхання; метгемоглобінемія; підвищення артеріального тиску і частоти серцевих скорочень; протеїнурія, гематурія (кров у сечі), травма сечового міхура; у тварин: тератогенний ефект.[21]
При дослідженні метаболізму дифеніламіну в зібраних і оброблених яблуках через різні часові інтервали було виявлено, що радіоактивно мічені залишки дифеніламіну проникають із поверхні в пульпу, яка через 40 тижнів містила 32 % залишку. Дифеніламін завжди був основним залишком, але у зразках яблук у значних кількостях було виявлено 3 метаболіти, експерти яких визнали недостатніми.[5][22] Існує прогалина в даних про наявність або утворення нітрозамінів в метаболізмі яблук або під час переробки. Канцероген 4-амінобіфеніл може супроводжувати дифеніламін як домішка.[21]
Дифеніламін має низьку гостру і короткочасну токсичність для птахів, але дуже токсичний для водних організмів. Ризик для біологічних методів очищення стічних вод був оцінений як низький.[5]
Домішка у комерційному дифеніламіні, що викликає полікістоз нирок у щурів, була виявлена в 1981 році. Лабораторні дослідження з високоочищеним дифеніламіном показали, що домішка може утворюватися з нагріванням дифеніламіну.[23]
Примітки
- https://www.sigmaaldrich.com/Graphics/COfAInfo/SigmaSAPQM/SPEC/24/242586/242586-BULK_______SIAL_____.pdf
- NIOSH Pocket Guide to Chemical Hazards #0240. Національний інститут охорони праці (NIOSH).
- Diphenylamine.
- P. F. Vogt, J. J. Gerulis, «Amines, Aromatic» in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim.
- Conclusion on the peer review of the pesticide risk assessment of the active substance diphenylamine. EFSA Journal 10: 2486. 25 січня 2012. doi:10.2903/j.efsa.2012.2486.
- «Identification of toxic impurities in commercial Diphenylamine», Bulletin of Environmental Contamination and Toxicology, February 1977, Volume 17, Issue 2, pp 204—207.
- CDC - NIOSH Pocket Guide to Chemical Hazards - Diphenylamine. www.cdc.gov. Процитовано 13 травня 2021.
- The Merck Index, 10th Ed., (1983), p.485, Rahway: Merck & Co.
- T. Kahl, K.-W. Schröder, F. R. Lawrence, W. J. Marshall, Hartmut Höke, Rudolf Jäckh, «Aniline» in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH: Weinheim.
- Triphenylamine. Org. Synth.
- Ingle, M; M. C. D'Souza (1989). Physiology and control of superficial scald of apples: a review. HortScience 24 (28): 31.
- Cook, Stanley G (1935). Determination of Diphenylamine in Smokeless Powders. Industrial & Engineering Chemistry Analytical Edition 7 (4): 250–255. doi:10.1021/ac50096a019.
- Leggett, Lana S; Lott, Peter F (1989). Gunshot residue analysis via organic stabilizers and nitrocellulose. Microchemical Journal 39: 76–85. doi:10.1016/0026-265X(89)90012-X.
- Drzyzga, Oliver (2003). Diphenylamine and derivatives in the environment: A review. Chemosphere 53 (8): 809–818. Bibcode:2003Chmsp..53..809D. PMID 14505701. doi:10.1016/S0045-6535(03)00613-1.
- Jun Dong; Cyril A. Migdal (2009). 1. Antioxidants. У Leslie R. Rudnick. Lubricant Additives: Chemistry and Applications (вид. 2nd). CRC Press. с. 3–50. ISBN 978-1420059656.
- Canady, Richard; Richard Lane; Greg Paoli; Margaret Wilson; Heidi Bialk; Steven Hermansky; Brent Kobielush; Ji-Eun Lee та ін. (Oct 2013). Determining the Applicability of Threshold of Toxicological Concern Approaches to Substances Found in Foods. Crit Rev Food Sci Nutr 53 (12): 1239–1249. PMC 3809586. PMID 24090142. doi:10.1080/10408398.2012.752341.
- Willard, H. H; Manalo, G. D (1947). Derivatives of Diphenylamine as Oxidation-Reduction Indicators in Alkaline Solution. Analytical Chemistry 19 (3): 167–170. doi:10.1021/ac60003a011.
- Sarver, L. A; Kolthoff, I. M (1931). Diphenylamine Sulfonic Acid as a New Oxidation-Reduction Indicator. Journal of the American Chemical Society 53 (8): 2902–2905. doi:10.1021/ja01359a010.
- Sarver, L. A; Kolthoff, I. M (1937). Electrochemical Properties of Diphenylbenzidine Sulfonic Acid. Journal of the American Chemical Society 59: 23–25. doi:10.1021/ja01280a007.
- Sriramam, K (1977). Mechanistic interpretation of the redox behaviour of diphenylamine. Talanta 24 (1): 31–36. PMID 18962017. doi:10.1016/0039-9140(77)80181-1.
- Diphenylamine. NIOSH Pocket Guide to Chemical Hazards. CDC NIOSH. 4 квітня 2011. Процитовано 29 квітня 2014.
- fao (2007). 2007 JMPR Evaluation, Diphenylamine (030) 155-189. Joint FAO/WHO Meeting on Pesticide Residues. WHO, FAO. с. 1–35. Процитовано 29 квітня 2014.
- Clegg, S; Safe, S; Crocker, JF (1981). Identification of a toxic impurity in commercial diphenylamine. J Environ Sci Health B 16 (2): 125–30. PMID 7252059. doi:10.1080/03601238109372245.