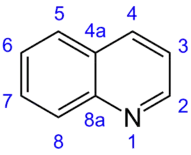
Хінолін
Хінолі́н — органічна речовина, ароматична гетероциклічна сполука. Молекула складається з двох анельваних ароматичних шестичленних кілець — бензенового та піридинового. Брутто-формула C9H7N. Хінолін може розглядатися як молекула нафталіну у якій один з вуглеців заміщено на азот. Хінолін — безбарвна, гігроскопічна рідина.[3][4] Дипольний момент молекули становить 2,29 D[5]
| Хінолін | |
|---|---|
 | |
 | |
| Назва за IUPAC | Хінолін |
| Інші назви | 1-бензазин, 1-азанафтален, бензо[b]піридин |
| Властивості | |
| Молекулярна формула | C9H7N |
| Молярна маса | 129,16 г/моль |
| Густина | 1,093 г/мл[1] |
| Тпл | −15 °C |
| Ткип | 108—110 °C/11mm Hg |
| Розчинність (вода) | Soluble |
| Кислотність (pKa) | 4.85[2] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Поширення у природі

У вільній формі хінолін у природі не зустрічається. Проте хінолінове ядро входить до складу багатьох алкалоїдів.[6]
Номенклатура
Хінолін також можна називати Бензопіридин та 1-Азанафтален
Отримання
Промисловий метод
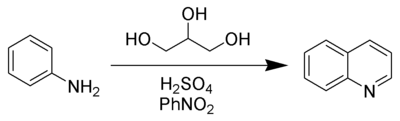
Синтез хіноліну з аніліну та гліцерину (синтез Скраупа) було проведено Зденко Скраупом в 1880 році.[7]
- Синтез за Нематовскі (Niemantowski)[12]:
Інші шляхи синтезу
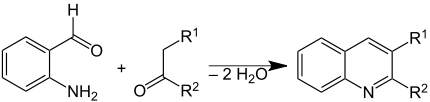
Відомо багато синететичних реакцій приготування заміщених хінолінів:[13]
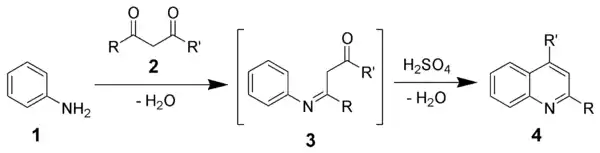
- Conrad-Limpach-Synthese — Реакція аніліну з β-кетоестерами [14]
- Реакція Поварова (циклоприєднання активованого алкену до основи Шифа утвоненої анілном та альдегідом [15] [16] [17], [18]
- Camps-Chinolinsynthese (циклізація о-ациламіно-ацетофенону в лужному середовищі)[19]
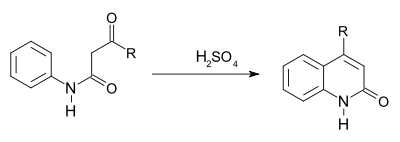
- Синтез Кнорра[20] — циклізація β-кетоаніліду в 2-гідроксихінолін в присутності сірчаної кислоти. (Вперше описано Ludwig Knorr в 1886р [21])
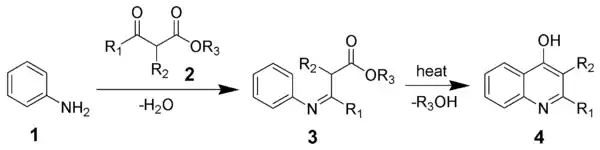
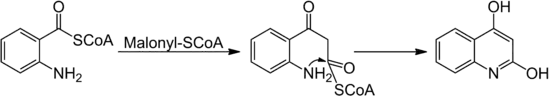
- Gould-Jacobs-Reaktion[22] (конденсація аніліну з етоексиметиленмалонатами в 3-карбокси-4-гідроксихінолін) [23].
- Синтез Комба (Combes) — конденсація незаміщеного аніліну з β-дикетоном, що протікає через основу Шиффа та дає хінолін після циклізації в кислому середовищі.[24][25]
Деякі похідні хіноліну є алкалоїдами. Більшість з них в клітинах синтезується, виходячи з триптофану [26]
Фізичні властивості
За нормальних умов хінолін — безбарвна рідина (Ткип=237,2 °C, Тпл= −14,8 °C[4]), з високим показником заломлення світла (1,6262 при 21 °C і λ=589 нм[27] Густина 1,10 г/см³.[4] Хінолін діамагнітний(−86,1·10−6 см3·моль−1)[28] und weist ein Дипольний момент молекули хіноліну 2,29 D.[5] В'язкість при 25 °C становить 3,337 мПа·с.−1[29], а теплопровідність — 0,147 W·(m·K)−1.[30]
Хінолін кристалізується в моноклинну ґратку (P21/c) з параметрами a = 992 пм, b = 1085 пм, c = 1337 пм і β = 106,5° (8 молекул на комірку). Слабкі водневі зв'язки C-H-N і C-H-(π-система).[31]
На противагу піридину, хінолін погано розчиняється у воді (6г/л при 20 °C).[1] З органічними розчинниками (етанол, ацетон, вуглеводи) хінолін змішується повністю.[4]
Будова молекули
Хінолін має кон'юговану систему з десятьма π-електронами, аналогічну до нафталінової. Молекула плоска й підпадає під правило Хюкеля (4n+2 електрони) для ароматичних систем. Атом азоту відтягує електронну густину з кільця. Всі атоми кілець хіноліну мають sp2-гібридизацію.
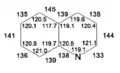 Довжини зв'язків та кути в молекулі хіноліну
Довжини зв'язків та кути в молекулі хіноліну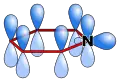 Пі-електронна густина в молекулі хіноліну
Пі-електронна густина в молекулі хіноліну
Хімічні властивості
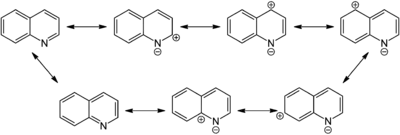
Хінолін — слабка основа. Він протонується сильними кислотами по азоту, утворюючи солі (наприклад, гідрохлорид (C9H7N·HCl), Т пл. 134 °C.[32] З кислотами Льюїса утворює продукти приєднання (аналогічно піридину). Атом азоту має sp2 гібридизацію й проявляє відповідні властивості «піридинового азоту».
Ароматична система хіноліну збіднена електронами порівняно з аналогічною пі-системою нафталіну. Він важче вступає в реакції електрофільного заміщення та окислення, які переважно протікають в бензольному ядрі. Натомість реакції нуклеофільного заміщення характерні для позицій 2 та 4 піридинового ядра.
Електрофільне заміщення
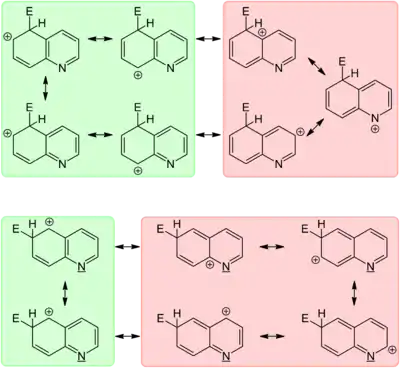
Піридинове кільце хіноліну дезактивоване, електрофільне заміщення протікає в положення 5 та 8 бензольного ядра.
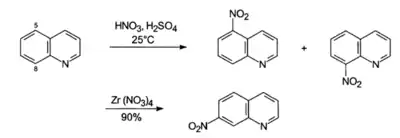
- Сульфування олеумом при помірних температурах (90 °C) відбувається у позицію 8 (і частково 5), оскільки перехідний стан має нижчу енергію (кінетичний контроль реакції). Натомість при температурі 250—300nbsp;°C утворюється термодинамічно стабільніший ізомер заміщений по позиції 6.[33] Відносно чистий продукт сульфування по позиції 5 можна отримати проводячи реакцію в присутності сульфату ртуті(ІІ).
- Галогенування хіноліну молекулярними галогенами потребує жорстких умов. Бромування в сірчаній кислоті дає 5- та 8-бромхінолін.[34] Виходячи з гідроброміду хіноліну можна провести заміщення по позиції 3.[35]
Нуклеофільне заміщення
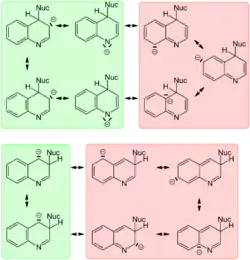
Багато реакцій нуклеофільного заміщення хіноліну протікають аналогічно реакціям піридину, переважно в електронно-дефіцитне положення 2 піридинового кільця.
Реакція Чичибабіна (амінування за допомогою аміду калію в рідкому аміаку) при −66 °C протікає в альфа-положення до азоту[36]. При збільшенні температури реакції до −40 °C, відбувається ізомеризація в термодинамічно більш стабільний 4-заміщений продукт[37]. Така сама закономірність має місце і для літіювання (2- термодинамічний контроль 4- кінетичний контроль).
Хінолін може бути напряму проалкільований бутиллітієм; утворений продукт приєднання по позиції 2 гідролізується водою та легко ароматизується (дегідрується) нітробензолом. [38]
Окислення та відновлення
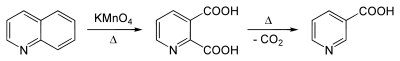
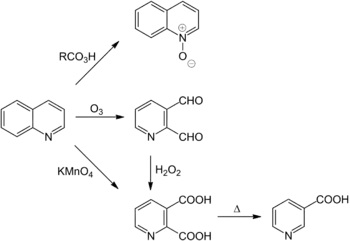
Хінолін можна окислити пербензойною кислотою в N-оксид (аналог піридин-N-оксиду).[39] Бензенове ядро багатше пі-електронами й легше окислюється. Так при дії KMnO4 (перманганат калію) утворюється хінолінова кислота[40], MnO2[41] чи азотна кислота[41] дають той же продукт:
Озоноліз хіноліну приводить до піридин-2,3-диальдегіду[42], який може бути окиснено використовуючи пероксид водню в хінолінову кислоту.[43]
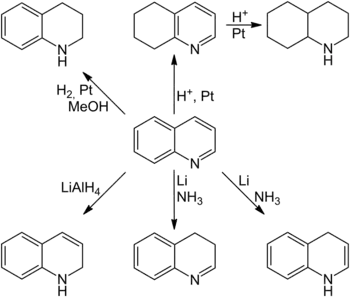
У залежності від умов реакції можна селективно прогідрувати як бензольне так і піридинове кільце хіноліну. Водень в метанолі на платиновому каталізаторі відновлює піридинове ядро.[44] Це ж кільце гідрується ціаноборогідридом натрію[45], борогідридом натрію[46], борогідридом цинку [47] в присутності хлориду нікелю(ІІ). Селективне гідрування бензольного ядра можливе в сильнокислому середовищі (H2/Pt).[48] (або TFA/PtO2/H2) При дещо жорсткіших умовах і тривалішому проведенні реакції можна досягти повного гідрування подвійних зв'язків.[44] Літійалюмогідрид може відновити хінолін до 1,2-дигідрохіноліну [49] В той же час обробка літієм в рідкому амоніаку дає 1,4-[50] та/чи 3,4-дигідрохінолін[44]. Останні сполуки легко вступають в подальші реакції та ізомеризуються.
Примітки
- Технічний лист Хінолін отримано з Merck, 5. September 2010.
- Brown, H.C., et al., in Baude, E.A. and Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- Römpp Online — Version 3.5, 2009, Georg Thieme Verlag, Stuttgart.
- D. R. Lide (Hrsg.): Handbook of Chemistry and Physics, 90. Auflage, S. 3-454, CRC Press, Boca Raton, 2009; ISBN 978-1-4200-9084-0.
- A. D. Buckingham, J. Y. H. Chau, H. C. Freeman, R. J. W. Le Fèvre, D. A. A. S. Narayana Rao, J. Tardif: The dipole moments of pyridine, quinoline, and isoquinoline as vapours and as solutes, in: J. Chem. Soc. 1956, 1405—1411; DOI:10.1039/JR9560001405.
- M. Hesse: Alkaloide, S. 375-378, 1. Auflage, Verlag Helvetica Chimica Acta, Zürich, 2000, ISBN 3-906390-19-5.
- Z. H. Skraup: Eine Synthese des Chinolins, in: Chem. Ber. 1880, 13, 2086—2087; DOI:10.1002/cber.188001302195.
- A. Shaabani, E. Soleimani, Z. Badri: Triflouroacetic Acid as an Efficient Catalyst for the Synthesis of Quinoline, in: Synth. Commun. 2007, 37, 629—635; DOI:10.1080/00397910601055230.
- C.-S. Jia, Z. Zhang, S.-J. Tu, G.-W. Wang: Rapid and efficient synthesis of poly-substituted quinolines assisted by p-toluene sulphonic acid under solvent-free conditions: comparative study of microwave irradiation versus conventional heating, in: Org. Biomol. Chem. 2006, 4, 104—110; DOI:10.1039/b513721g.
- J. Wu, H.-G. Xia, K. Gao: Molecular iodine: a highly efficient catalyst in the synthesis of quinolines via Friedländer annulation, in: Org. Biomol. Chem. 2006, 4, 126—129; DOI:10.1039/b514635f.
- R. Varala, R. Enugala, S. R. Adapa: Efficient and Rapid Friedlander Synthesis of Functionalized Quinolines Catalyzed by Neodymium(III) Nitrate Hexahydrate, in: Synthesis 2006, 3825-3830; DOI: 10.1055/s-2006-950296.
- R. H. Manske: The Chemistry of Quinolines., in: Chem. Rev. 1942, 30, 113—144; DOI:10.1021/cr60095a006.
- V. V. Kouznetsov , L. Y. V. Méndez , L. Y. V. Gómez: Recent Progress in the Synthesis of Quinolines, in: Curr. Org. Chem. 2005, 9, 141—161; DOI:10.1002/chin.200516245.
- R. H. Reitsema: The Chemistry of 4-Hydroxyquinolines., in: Chem. Rev. 1948, 43, 43-68; DOI:10.1021/cr60134a002.
- Povarov, L. S.; Mikhailov, B. M. Izv. Akad. Nauk SSR, Ser. Khim. 1963, 953—956.
- Povarov, L. S.; Grigos, V. I.; Mikhailov, B. M. Izv. Akad. Nauk SSR, Ser. Khim. 1963, 2039—2041.
- Povarov, L. S. Russian Chem. Rev. 1967, 36, 656.
- F. W. Bergstrom, Heterocyclic Nitrogen Compounds. Part IIA. Hexacyclic Compounds: Pyridine, Quinoline, and Isoquinoline., in: Chem. Rev. 1944, 35, 77-277; DOI:10.1021/cr60111a001.
- R. Camps: Synthese von alpha- und gamma-Oxychinolinen, in: Chem. Ber. 1899, 22, 3228; DOI:10.1002/cber.18990320389.
- L. Knorr: Synthetische Versuche mit dem Acetessigester, in: Liebigs Ann. 1886, 236, 69-115; DOI:10.1002/jlac.18862360105.
- Synthetische Versuche mit dem Acetessigester Justus Liebig's Annalen der Chemie Volume 236, Issue 1-2, Date: 1886, Pages: 69-115 Ludwig Knorr DOI:10.1002/jlac.18862360105
- R. G. Gould, W. A. Jacobs: The Synthesis of Certain Substituted Quinolines and 5,6-Benzoquinolines, in: J. Am. Chem. Soc. 1939, 61, 2890—2895; DOI:10.1021/ja01265a088.
- Organic Syntheses, Coll. Vol. 3, p.272 (1955); Vol. 28, p.38 (1948). Link
- Combes, A. Bull. Chim. Soc. France 1888, 49, 89.
- Bergstrom, F. W. Chem. Rev. 1944, 35, 156. (Review)
- P. M. Dewick: Medicinal Natural Products: A Biosynthetic Approach, 1. Auflage, S. 380-397, John Wiley & Sons, New York, 2009, ISBN 0-470-74167-8.
- W. H. F. Sasse: Synthetical applications of activated metal catalysts. Part VIII. The action of degassed Raney nickel on quinoline and some of its derivatives, in: J. Chem. Soc. 1960, 526—533; DOI:10.1039/JR9600000526.
- D. R. Lide (Hrsg.): Handbook of Chemistry and Physics, 90. Auflage, S. 3-675, CRC Press, Boca Raton, 2009; ISBN 978-1-4200-9084-0.
- D. R. Lide (Hrsg.): Handbook of Chemistry and Physics, 90. Auflage, S. 6-212, CRC Press, Boca Raton, 2009; ISBN 978-1-4200-9084-0.
- D. R. Lide (Hrsg.): Handbook of Chemistry and Physics, 90. Auflage, S. 6-223, CRC Press, Boca Raton, 2009; ISBN 978-1-4200-9084-0.
- J. E. Davies, A. D. Bond: Quinoline, in: Acta Cryst. 2001, E57, S. o947-o949; DOI:10.1107/S1600536801014891.
- O. Eckstein: Ueber Chinolin-chlorhydrat und die Einwirkung von Säurechloriden auf Chinolin, in: Chem. Ber. 1906, 39, 2135—2138; DOI:10.1002/cber.190603902173.
- G. E. McCasland: The Preparation of 8-Qinolinesulfonic acid, in: J. Org. Chem. 1946, 11, 277—280; DOI:10.1021/jo01173a010.
- J. L. Butler, M. Gordon: A reinvestigation of known bromination reactions of quinoline, in: J. Heterocycl. Chem. 1975, 12, 1015—1020; DOI:10.1002/jhet.5570120539.
- T. J. Kress, S. M. Constantino: Selective brominations in nitrobenzene. A convenient synthesis of 3-brornoquinoline, 4-bromoisoquinoline, and 4-phenyl-5-bromopyrimidine, in: J. Heterocycl. Chem. 1973, 10, 409—410; DOI:10.1002/jhet.5570100326.
- H. van der Plas: Oxidative Amino-Dehydrogenation of Azines, in: Adv. Heterocycl. Chem. 2004, 86, 1-40; DOI:10.1016/S0065-2725(03)86001-4.
- J. A. Zoltewicz, L. S. Helmick, T. M. Oestreich, R. W. King, P. E. Kandetzki: Addition of amide ion to isoquinoline and quinoline in liquid ammonia. Nuclear magnetic resonance spectra of anionic σ-complexes, in: J. Org. Chem. 1973, 38, 1947—1949; DOI:10.1021/jo00950a036.
- T. J. Geissmann, M. J. Schlatter, I. D. Webb, J. D. Roberts: The Synthesis of some Intermediates for the Use in the Preparation of Analogs of Salicylaldehyde ethylenediimine cobalt («Salcomine»), in: J. Org. Chem. 1946, 11, 741—750; DOI:10.1021/jo01176a015.
- J. Meisenheimer: Über Pyridin-, Chinolin— und Isochinolin-N-oxyd., in: Ber. Dtsch. Chem. Ges. 1926, 59, 1848—1853; DOI:10.1002/cber.19260590828.
- C. F. Koelsch, A. F. Steinhauer: Synthesis, Nitration, and Oxidation of 3-Azafluoranthene, in: J. Org. Chem. 1953, 18, 1516—1522; DOI:10.1021/jo50017a010.
- J. C. Cochran, W. F. Little: Electrolytic Oxidation of Some Substituted Quinolines to Quinolinic Acids and Acylations with Substituted Quinolinic Anhydrides, in: J. Org. Chem. 1961, 21, 808—811; DOI:10.1021/jo01062a039.
- G. Queguiner, P. Pastour: Synthèse dans la série de la pyridine — I — Les diformylpyridines, in: Bull. Soc. Chim. Fr. 1968, 10, 4117-4121.
- C. O'Murchu: Ozonolysis of Quinolines: A Versatile Synthesis of Polyfunctional Pyridines, in: Synthesis 1989, 11, 880—882; DOI:10.1055/s-1989-27423.
- J. A. Joules, K. Mills: Heterocyclic Chemistry, 5. Auflage, S. 177—199, Blackwell Publishing, Chichester, 2010, ISBN 978-1-4051-9365-8.
- G. R. Girard, W. E. Bondinell, L. M. Hillegass, K. G. Holden, R. G. Pendleton, I. Uzinskas: Tetrahydro thiadiazolo isoquinolines: synthesis and inhibition of phenylethanolamine-N-methyltransferase, in: J. Med. Chem. 1989, 32, 1566—1571; DOI:10.1021/jm00127a027.
- A. Nose, T. Kudo: Reduction of Heterocyclic Compounds. II. Reduction of Heterocyclic Compounds with Sodium Borohydride-Transition Metal Salt Systems, in: Chem. Pharm. Bull. 1984, 32, 2421—2425; Abstract.
- B. C. Ranua, U. Janaa, A. Sarkara: Regioselective Reduction of Quinolines and Related Systems to 1,2,3,4-Tetrahydro Derivatives with Zinc Borohydride, in: Synth. Commun. 1998, 28, 485—492; DOI:10.1080/00397919808005103.
- G. L. Patrick: Synthesis of (±)-[4aα,4bβ,10bβ,12aα]-9-halogeno-2-methyl-1,2,3,4,4a,4b,5,6,10b,11,12,12a-dodecahydronaphtho[2,1-]isoquinolines, in: J. Chem. Soc., Perkin Trans. 1 1995, 1273—1279; DOI:10.1039/P19950001273.
- E. A. Braude, J. Hannah, Sir R. Linstead: Hydrogen transfer. Part XVI. Dihydrides of nitrogenous heterocycles as hydrogen donors, in: J. Chem. Soc. 1960, 3249-3257; DOI:10.1039/JR9600003249.
- A. J. Birch, P. G. Lehmann: 1,4-Dihydrochinolin, in: Tetrahedron Lett. 1974, 15, 2395—2396.
Література
- T. Eicher, S. Hauptmann: The Chemistry of Heterocycles, 2. Auflage, Wiley-VCH, Weinheim 2003, ISBN 3-527-30720-6.
- J. A. Joule, K. Mills: Heterocyclic Chemistry, 3. Auflage, Blackwell Science, Oxford 2004, ISBN 0-632-05453-0.
- D. T. Davies: Basistexte Chemie: Aromatische Heterocyclen, 1. Auflage, Wiley-VCH, Weinheim 1995, ISBN 3-527-29289-6.