Реакція Судзукі
Реа́кція Судзу́кі (також Реакція Судзукі — Міяури) — каталізована паладієм реакція крос-сполучення боронових кислот з галогенідами[1][2].
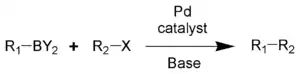
Реакція найкраще відпрацьована для синтезу біарилів, проте нові каталізатори і синтетичні методи значно розширили область застосування цієї реакції; як компоненти можна використовувати не лише арил-, але й алкіл-, алкеніл- та алкінілпохідні. Замість боронових кислот можна використовувати похідні 9-борабіцикло[3.3.1]нонану (BBN), органотрифлуороборатні солі або боронові естери (в першу чергу пінаколати, що просто одержуються в реакції Міяури). Реакція також може проходити з псевдогалогенідами, такими як трифлати (CF3SO3–) або нонафлати CF3CF2CF2CF2SO3–)[3]. Реакційна здатність субстратів спадає у ряду R2-I > R2-OTf > R2-Br >> R2-Cl, причому за присутності в будь-якій комноненті атомів хлору, каплінґ з використанням йодпохідних проходить селективно. Фториди до реакції Судзукі не вступають. Реакція каталізується фосфіновими або карбеновими комплексами паладію(0). По реакції Судзукі було опубліковано декілька оглядових статей[4][5][6][7]. Реакція широко застосовується при синтезі поліолефінів, стиренів та біарилів. Реакцію вперше опублікували в 1979 році Акіра Судзукі та Норіо Міяура. За відкриття цієї реакції Акіра Судзукі в 2010 році отримав Нобелівську премію з хімії.
Механізм
Механізм реакції Судзукі розглядають з точки зору перетворень паладієвого каталізатора. Першим кроком є окиснювальне приєднання паладію до галогеніду 2 з утворенням органопаладієвих молекул 3. Взаємодія з основою призводить до утворення інтермедіату 4, який через трансметалювання[8] з боронатним комплексом 6 перетворюється на органопаладієві молекули 8. У результаті відновного елімінування (відщеплення) бажаного продукту 9 знову утворюється початковий каталізатор 1.
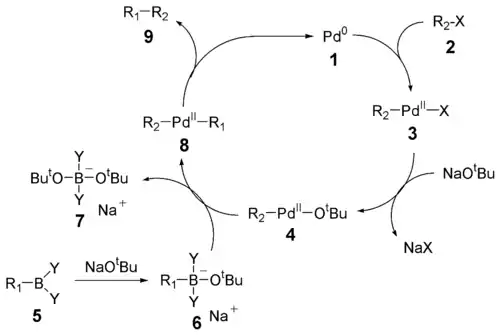
Окиснювальне приєднання
Окиснювальне приєднання відбувається зі збереженням стереохімії вінілгалогенідів, однак призводить до обернення стереохімії алільних та бензильних гагогенідів[9][10]. Внаслідок окиснювального приєднання спочатку утворюєтсься цис-паладієвий комплекс, які одразу ж ізомеризується до транс-комплексу[11].
Відновне відщеплення
Використовуючи маркування Дейтерієм, Ріджвей (англ. Ridgway) та ін. показав, що відновне відщеплення відбувається зі збереженням стереохімії[12]. Також була досліджена відносна реакційна здатність різних металічних комплексів у С-С відновному відщепленні: Pd(IV), Pd(II) > Pt(IV), Pt(II), Rh(III) > Ir(III), Ru(II), Os(II)[13].
Застосування
Реакція Судзукі набула широкого застосування у синтезі складних органічних сполук[14]. Реакцію Судзукі використали при синтезі з цитронелалю капарратрієну — природного продукту, який є дуже активним проти лейкемії[15].
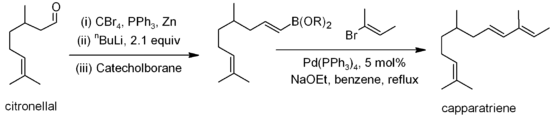
Див. також
- Реакція Гека
- Реакція Неґіші
- Реакція Стілле
Примітки
- Miyaura, Norio; Yamada, Kinji ; Suzuki, Akira (1979). A new stereospecific cross-coupling by the palladium-catalyzed reaction of 1-alkenylboranes with 1-alkenyl or 1-alkynyl halides. Tetrahedron Letters 20 (36): 3437–3440. doi:10.1016/S0040-4039(01)95429-2.
- Miyaura, Norio; Suzuki, Akira (1979). Stereoselective synthesis of arylated (E)-alkenes by the reaction of alk-1-enylboranes with aryl halides in the presence of palladium catalyst. Chem. Comm. (19): 866–867. doi:10.1039/C39790000866.
- Miyaura, Norio; Suzuki, Akira (2007). First Comprehensive Investigation of Suzuki Couplings of Alkenyl Nonaflates with Aryl and Alkenyl Boronic Acid Derivatives by Using Classical Conditions and Microwave Heating. Chemistry an European Journal 13 (8): 2410–2420. doi:10.1002/chem.200601394.
- Suzuki, A. Pure Appl. Chem. 1991, 63, 419—422. (Review)
- Miyaura, Norio; Suzuki, Akira (1979). Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. Chemical reviews 95 (7): 2457–2483. doi:10.1021/cr00039a007.(Review)
- Suzuki, A. J. Organometallic Chem. 1999, 576, 147—168. (Review)
- Miyaura, Norio; Suzuki, Akira (1995). Palladium-Catalyzed Cross-Coupling Reactions of Organoboron Compounds. Chemical Reviews 95 (7): 2457–2483. doi:10.1021/cr00039a007.
- Matos, K.; Soderquist, J. A. J. Org. Chem. 1998, 63, 461—470. (DOI:10.1021/jo971681s)
- Stille, J. K.; Lau, K. S. Y. Acc. Chem. Res. 1977, 10, 434—442. (DOI:10.1021/ar50120a002)
- Архівована копія. Архів оригіналу за 23 вересня 2005. Процитовано 27 травня 2012.
- Casado, A. L.; Espinet, P. Organometallics 1998, 17, 954—959.
- Ridgway, B. H.; Woerpel, K. A. J. Org. Chem. 1998, 63, 458—460. (DOI:10.1021/jo970803d)
- (a) J. Am. Chem. Soc., 2002, 124 (11), 2839; DOI:10.1021/ja017476i. (b) Organometallics, 2005, 24, 715. DOI:10.1021/om0490841
- (a) A. Balog, D. Meng, T. Kamenecka, P. Bertinato, D.-S. Su, E.J. Sorensen and S.J. Danishefsky, «Total Synthesis of (–)-Epothilone A» Angew. Chem., Int. Ed. Engl., 1996, 35, 2801. DOI:10.1002/anie.199628011 (b) J. Liu, S. D. Lotesta and E. J. Sorensen, «A concise synthesis of the molecular framework of pleuromutilin», Chem. Commun., 2011, 47, 1500. DOI:10.1039/C0CC04077K
- Vyvyan, J.R. (1999). An expedient total synthesis of (+/-)-caparratriene. Tetrahedron Letters 40 (27): 4947–4949. doi:10.1016/S0040-4039(99)00865-5. Процитовано 2 січня 2008.
Посилання
- Реакція Судзукі на сайті www.organic-chemistry.org. (англ.)
Література
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
