Силікат натрію
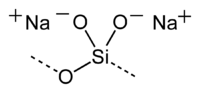
Силіка́т на́трію, ме́тасиліка́т на́трію — неорганічна сполука, натрієва сіль силікатної кислоти складу Na2SiO3. За звичайних умов є білою, аморфною речовиною, що плавиться без розкладання.
| Силікат натрію | |
|---|---|
 | |
 | |
| Назва за IUPAC | натрій метасилікат[1] |
| Інші назви | натрій силікат, натрій кремнекислий |
| Ідентифікатори | |
| Номер CAS | 6834-92-0 |
| Номер EINECS | 229-912-9 |
| ChEBI | 60720 |
| RTECS | VV9275000 |
| SMILES |
[O-][Si](=O)[O-].[Na+].[Na+][2] |
| InChI |
InChI=1S/2Na.O3Si/c;;1-4(2)3/q2*+1;-2 |
| Номер Бельштейна | 11343143 |
| Властивості | |
| Молярна маса | 122,064 г/моль |
| Зовнішній вигляд | біла аморфна речовина |
| Густина | 2,61 г/см³ |
| Тпл | 1089 °C |
| Розчинність (вода) | нерозчинний |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
1554,9 кДж/моль |
| Ст. ентропія S |
113,9 Дж/(моль·K) |
| Теплоємність, c |
111,9 Дж/(моль·K) |
| Пов'язані речовини | |
| Інші аніони | карбонат натрію |
| Інші катіони | силікат калію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Отримання
Основним методом синтезу метасилікату натрію є високотемпературне сплавлення кальцинованої соди Na2CO3 з піском або кварцом:
Продукти реакції мають надзвичайно велику корозійну дію на стінки хімічного реактора і вимагають його періодичної заміни.
Іншим способом є взаємодія свіжоосадженого оксиду кремнію із точно розрахованою кількість гідроксиду натрію:
Хімічні властивості
Силікат натрію утворений аніоном дуже слабкої силікатної кислоти, він гідролізується у холодній воді, надаючи розчинові сильнолужну реакцію. В ході процесу утворюються складніші іони Si2O52-, H2SiO42-, H4SiO72-[3].
При взаємодії з гарячою водою з розчину випадає колоїдний осад — гідрозоль SiO2·nH2O:
Аналогічно виділяється з розчину силікатна кислота внаслідок реакції із кислотами:
При взаємодії з концентрованими лугами утворюється ортосилікат натрію:
Вуглекислий газ здатен заміщати оксид кремнію у силікат-аніоні:
Застосування
Силікат натрію є переважно компонентом, аніж реактантом. Маючи сильнолужну реакцію, основна його частина застосовується у виготовленні мила й детергентів.
У харчовій промисловості метасилікат використовується як антиспікаючий агент і зареєстрований у системі харчових добавок за номером E550[4].
Примітки
- Nomencature of Inorganic Chemistry. IUPAC Recommendations 2005. — RSC Publishing, 2005. — P. 333. — ISBN 0-85404-438-8. (англ.)
- Sodium metasilicate
- Реми, 1963, с. 536.
- Class names and the International Numbering System for food additives. codexalimentarius.org. World Health Organization. Прийнято у 1989; остання правка у 2015. Процитовано 2 березня 2016.
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Falcone Jr, James S. Silicon Сompounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 22. — P. 7. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Реми Г. Курс неорганической химии / Под ред. А. В. Новоселовой. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)