Трихлороцтова кислота
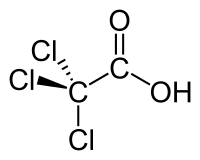
Трихлороцтова кислота — це галогенкарбонова кислота з хімічною формулою . За звичайних умов є безбарвними кристалами, добре розчинними у воді[1].
| Трихлороцтова кислота | |
|---|---|
 | |
 | |
| Назва за IUPAC | 2,2,2-трихлоретанова кислота |
| Ідентифікатори | |
| Номер CAS | [1] 76-03-9 [1] |
| Номер EINECS | 200-927-2 |
| Номер EC | [1] 200-927-2 [1] |
| DrugBank | 11152 |
| KEGG | D08633 |
| Назва MeSH | D02.241.081.018.214.750 і D02.455.526.439.196.750 |
| ChEBI | 30956 |
| RTECS | AJ7875000 [1] |
| SMILES |
C(=O)(C(Cl)(Cl)Cl)O [1] |
| InChI |
InChI=1S/C2HCl3O2/c3-2(4,5)1(6)7/h(H,6,7) [1] |
| Номер Бельштейна | 970119 |
| Номер Гмеліна | 2842 |
| Властивості | |
| Молекулярна формула | C2HCl3O2 [1] |
| Молярна маса | 161,904212 г/моль [1] |
| Молекулярна маса | 163,38 а.о.м. [1] |
| Густина | 1.6126 (64 °C) [1] |
| Тпл | 58°C [1] |
| Ткип | 195,5°C — 198°C [1] |
| Розчинність (вода) | 120 г/100г [1] |
| Розчинність (метанол) | 2143 г/100г [1] |
| Тиск насиченої пари | 133 Pa (51°C) [1] |
| Небезпеки | |
| ГГС піктограми | 
|
| ГГС формулювання небезпек | H314, H440, H410 |
| ГГС запобіжних заходів | P260, P264, P273, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338
,P310, P321, P363, P391, P405, P501 [1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
Уперше синтезована 1840 року хлоруванням оцтової кислоти на сонячному світлі.[2]
Хімічні властивості
Трихлороцтова кислота має всі властивості, характерні для галогенкарбонових кислот. Вступає у реакції нуклеофільного заміщення[3].
Трихлороцтова кислота є достатньо сильною кислотою: pH її розчину з молярністю 0,1 становить 1,2, а pKa — 0,51[1].
При нагріванні з лугами або амінами декарбоксилюється з утворенням хлороформу[3][4]:
Отримання
- Трихлороцтову кислоту отримують α-галогенуванням оцтової кислоти чи хлороцтової кислоти. При цьому як каталізатор може бути застосований гіпохлорит кальцію, можливо сполуки феруму та купруму. Температура реакції — 140 - 160 °С:[5][2]
- Також отримують окисненням хлоралю нітратною кислотою[3]:
- Ще один спосіб отримання — окиснення тетрахлоретилену киснем у присутності води[3]:
Токсичність
Можливий канцероген, IARC відносить до групи 2B.[2]
Примітки
- Trichloroacetic acid | C2Cl3NaO2 - PubChem. pubchem.ncbi.nlm.nih.gov.
- Humans, IARC Working Group on the Evaluation of Carcinogenic Risks to (2014). TRICHLOROACETIC ACID (англ.). International Agency for Research on Cancer.
- Ю.О.Ластухін, С.А.Воронов (2009). Органічна хімія. Львів: Центр Європи. с. 454–456. ISBN 966-7022-19-6.
- Промышленные хлорорганические продукты:Справочник. 1978. с. 173.
- Koenig, Günter; Lohmar, Elmar; Rupprich, Norbert; Lison, Martin; Gnass, Alexander (15 жовтня 2012). У Wiley-VCH Verlag GmbH & Co. KGaA. Chloroacetic Acids. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a06_537.pub3. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a06_537.pub3.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
