Тріоксид молібдену
Триоксид молібдену (триоксид молібдену, тріоксомолібден) — бінарна неорганічна хімічна сполука кисню з молібденом.хімічна сполука з формулою . Ця сполука виробляється в великих масштабах з будь-якої сполуки молібдену. Це проміжний продукт у виробництві металевого молібдену. Це також важливий промисловий каталізатор[4]. Триоксид молібдену зустрічається як рідкісний мінеральний молібдит.
| Тріоксид молібдену | |
|---|---|
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки |
| Тріоксид молібдену | |
|---|---|
-oxid_Kristallstruktur.png.webp) |
 |
| Назва за IUPAC | Молібден триоксид |
| Інші назви | Molybdic ангідрид Молібдит Molybdic триоксид Молібден (VI) оксид |
| Ідентифікатори | |
| Номер CAS | 1313-27-5 |
| PubChem | 14802 |
| Номер EINECS | 215-204-7 |
| DrugBank | 15924 |
| ChEBI | 30627 |
| SMILES |
O=[Mo](=O)=O[1] |
| InChI |
InChI=1S/Mo.3O |
| Номер Гмеліна | 100822 |
| Властивості | |
| Молекулярна формула | MoO3 |
| Молярна маса | 143,94 г/моль |
| Зовнішній вигляд | жовтий чи блакитний solid |
| Запах | без запаху |
| Густина | 4,7 г / см3[2] |
| Тпл | 802 |
| Розчинність (вода) | 1,066 г / л (18 °C) 4,90 г / л (28 °C) 20,55 г / л (70°C) |
| Структура | |
| Кристалічна структура | орторомбічна, oP16 |
| Pnma, No. 62 | |
| Координаційна геометрія |
див. текст |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
−745,1 кДж / моль |
| Ст. ентропія S |
77,7 Дж К–1 моль–1 |
| Теплоємність, c |
75,0 Дж К–1 моль–1 |
| Небезпеки | |
| ЛД50 | 125 mg.kg (rat, oral)[джерело?] 2689 mg/kg (rat, oral)[3] |
| Класифікація ЄС | Carc. Cat. 3 Harmful (Xn) Irritant (Xi) |
| R-фрази | R36/37, R40 |
| S-фрази | S2, S22, S36/37 |
| NFPA 704 |
 0
3
0
|
| Температура спалаху | Non-flammable |
| Пов'язані речовини | |
| Інші катіони | Chromium trioxide Tungsten trioxide |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Будова
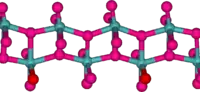
У газовій фазі три атоми кисню подвійно зв'язані з центральним атомом молібдену. У твердому стані безводний складається із шарів перекручених октаедрів кристалі ромбічної форми . Краї октаедрів утворюють ланцюжки, які з'єднані з атомами кисню, які і утворюють шари. Октаедри мають один короткий молібдено-кисневий зв'язок із киснем, що не є мостиком[5][6]. Відома також метастабільна (β) форма зі структурою, подібною до [7].
Підготовка та основні реакції
отримують промисловим шляхом випалу дисульфіду молібдену, основної руди молібдену[4]:
- →
Лабораторний синтез дигідрату передбачає підкислення водного розчину молібдату натрію перхлорною кислотою[8]:
- →
Дигідрат легко втрачає воду, що даючи моногідрат. Обидва яскраво-жовтого кольору.
Триоксид молібдену розчиняється у воді утворюючи «молібдову кислоту». В основі вона розчиняється, отримуючи аніон молібдату.
Використання
Триоксид молібдену використовується для виробництва молібденового металу, який служить добавкою в сталі та корозійно-стійких сплавів. Тягне за собою відповідні перетворення з в реакції з воднем при підвищених температурах:
- →
Крім того, є со-каталізатором для використання в промисловому виробництві акрилонітрилу шляхом окислення пропілену й аміаку.
Через свою шарувату структуру та легкість з'єднання Mo(VI)/Mo(V) представляє інтерес для електрохімічних пристроїв та дисплеїв[9]. Триоксид молібдену також пропонується як потенційний антимікробний засіб, наприклад, у полімерах. При контакті з водою він утворює йони які можуть ефективно вбивати бактерії[10].

Список літератури
- MOLYBDENUM TRIOXIDE
- Haynes, p. 4.77
- Roger F. Sebenik (2005). Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a16_655. ISBN 978-3527306732.
- Molybdite Mineral Data
- Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- McCarron, E. M. (1986). : A Metastable Analogue of . J. Chem. Soc., Chem. Commun.: 336–338. doi:10.1039/C39860000336.
- Heynes, J. B. B.; Cruywagen, J. J. (1986). Yellow Molybdenum(VI) Oxide Dihydrate. Inorganic Syntheses 24: 191–2. ISBN 9780470132555. doi:10.1002/9780470132555.ch56.
- Ferreira, F. F.; Souza Cruz, T. G.; Fantini, M. C. A.; Tabacniks, M. H.; de Castro, S. C.; Morais, J.; de Siervo, A.; Landers, R. та ін. (2000). Lithium insertion and electrochromism in polycrystalline molybdenum oxide films. Solid State Ionics. 136–137 (1–2): 357–363. doi:10.1016/S0167-2738(00)00483-5.
- Zollfrank, Cordt; Gutbrod, Kai; Wechsler, Peter; Guggenbichler, Josef Peter (2012). Antimicrobial activity of transition metal acid MoO3 prevents microbial growth on material surfaces. Materials Science and Engineering: C 32 (1): 47–54. PMID 23177771. doi:10.1016/j.msec.2011.09.010.
Цитовані джерела
Посилання
- Greenwood, Norman N. .; Ерншоу, Алан (1997). Хімія стихій (2-е видання). Баттерворт-Хайнеман . ISBN Greenwood, Norman N. Greenwood, Norman N.
- Національна програма з токсикології Міністерства охорони здоров'я та соціальних служб США
- Міжнародна асоціація молібдену
- Національна лабораторія Лос-Аламоса — молібден