Ураніл
Урані́л — неорганічний урановмісний катіон складу UO22+. Іноді уранілом називають вільний оксид урану(IV) UO2, що має подібні до металу властивості, та якій вважався німецьким хіміком Клапротом окремим металом, до того, як було виділено справжній елемент французом Пеліго[1].
Утворювані уранілом солі зазвичай є легкорозчинними кристалами жовтого кольору. Найбільш поширеними сполуками є уранілацетат, уранілнітрат, уранілсульфат, уранілфлуорид. На відміну від інших актиніл-іонів, ураніл здатен утворювати летючі оксохлорид UO2Cl2 і оксобромід UO2Br2.[2]
Будова
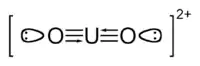
Іон UO22+ зазвичай має лінійну будову. Порядок зв'язку U—O тут більший за подвійний, умовно потрійний. Він утворюється перекриванням 5f- і 6d-орбіталей Урану з трьома p-орбіталями на атомах Оксигену (двома p- і однією sp-гібридною), внаслідок якого виникають один сигма- і два пі-зв'язки. Зв'язки U—O є надзвичайно сильними і вони майже завжди коротші за екваторіальні — відстань між ними складає 180 пм. В деяких сполуках уранілу кут O—U—O може дещо відхилятися від значення 180° на 5°–20°[3]
Поширення у природі
Сполуки уранілу є однією з переважних форм урану у мінеральних покладах. До основних представників належать:
|
|
Отримання
Сполуки уранілу утворюються при дії на уран водними розчинами кислот:
- ; E0=1,444 В
Стандартна ентальпія утворення іону в розчині складає -1019,0 Дж/(моль·K).
Однак, як правило в промисловості та лабораторній практиці сполуки уранілу отримують з інших сполук урану, зокрема, обробкою кислотами або газуватими галогеноводнями триоксиду, триуран-октоксиду, диокиду урану,
"пероксиду" урану U, тощо. .
Хімічні властивості
У воді сполуки уранілу гідролізуються і розчини набувають чітко вираженої кислотності. Процес гідролізу є доволі складним, він описується координуванням молекул води із відокремленням від них H+, а в подальшому супроводжується полімеризацією із утворенням OH-містків:
У кислих розчинах ураніл-іон відновлюється:
- ; E0=0,062 В
- ; E0=0,327 В
Примітки
- René, Miloš (20 грудня 2017). History of Uranium Mining in Central Europe. Uranium - Safety, Resources, Separation and Thermodynamic Calculation (англ.). doi:10.5772/intechopen.71962. Процитовано 15 травня 2019.
- Brown, D. (1 січня 1968). HALIDES OF THE LANTHANIDES AND ACTINIDES. (English). Процитовано 15 травня 2019.
- Pedrick, Elizabeth A.; Schultz, Jason W.; Wu, Guang; Mirica, Liviu M.; Hayton, Trevor W. (6 червня 2016). Perturbation of the O–U–O Angle in Uranyl by Coordination to a 12-Membered Macrocycle. Inorganic Chemistry 55 (11). с. 5693–5701. ISSN 0020-1669. doi:10.1021/acs.inorgchem.6b00799. Процитовано 15 травня 2019.
Джерела
- Greenwood, N. N., Earnshaw, A. Chemistry of the Elements. — 2nd. — Oxford : Butterworth-Heinemann, 1997. — P. 1273—1274. — ISBN 0-7506-3365-4. (англ.)
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Clark D. L., Neu M. P., Runde W., Keogh D. W. Uranium and uranium compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 24. — P. 314—315. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Реми Г. Курс неорганической химии / Под ред. А. В. Новоселовой. — М. : ИИЛ, 1966. — Т. 2. — С. 220. (рос.)


