Гібридизація орбіталей
Гібридиза́ція орбіта́лей — явище змішування атомних орбіталей визначеного атома із утворенням такого ж числа нових гібридних орбіталей, яким притаманна однакова форма та виражена просторова спрямованість. Гібридизація атомних орбіталей відбувається, зокрема, при виникненні ковалентних зв'язків між атомами.

Гібридизація орбіталей — формальний математичний прийом, який перекидає місток між делокалізованим описом електронної оболонки молекули в термінах молекулярних орбіталей (див. Метод молекулярних орбіталей) та локалізованим її описом в термінах зв'язуючих та вільних електронних пар (див. Метод валентних зв'язків).
Гібpидна орбіталь — атомна орбіталь, отримана змішуванням двох чи більше атомних орбіталей атома з різними значеннями орбітального квантового числа, має виражене просторове спрямування. Таке змішування є наслідком зниження симетрії атома при його входженні у взаємодію. Гібридні орбіталі атома з певним координаційним числом є подібними для переважної більшості органічних та неорганічних молекул. Проте для передбачення просторової структури молекул слід спиратися на фізично змістовні теорії, в першу чергу на теорію відштовхування електронних пар валентних оболонок.
Опис окремих типів гібридизації орбіталей
sp3-гібридизація. Відбувається при змішуванні однієї s- і трьох p-орбіталей. Виникає чотири однакові орбіталі, розташовані одна щодо іншої під тетраедричним кутом 109°28'. Прикладом sp³-гібридизації є молекула метану, або кристалічна ґратка типу алмазу (кремній, германій, арсенід галію).
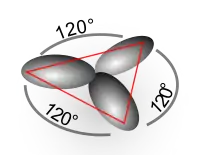
sp2-гібридизація. Відбувається при змішуванні однієї s- і двох p-орбіталей. Утворюється три гібридні орбіталі з осями, розташованими в одній площині і направленими до вершин правильного трикутника під кутом 120°. Негібридизована атомна p-орбіталь перпендикулярна площині і, як правило, бере участь в утворенні π-зв'язків. Прикладом sp²-гібридизації є молекула бензолу, ненасичені полімери, графіт.
sp-гібридизація. Відбувається при змішуванні однієї s- і однієї p-орбіталей. Утворюється дві рівноцінні sp-гібридні орбіталі, розташовані лінійно (під кутом 180°) і направлені в різні боки від ядра атома. Дві інші негібридні p-орбіталі розташовуються у взаємно перпендикулярних площинах. Приклад sp-гібридизації дають молекули ацетилену, алену та ланцюжок карбіну.
sp3d2-гібридизація Відбувається при змішуванні однієї s, трьох p та двох d атомних орбіталей, утворюється октаедральна структура.
sp2d-гібридизація. Відбувається при змішуванні однієї s, двох p та однієї d атомних орбіталей, утворюється плоска квадратна структура.
Ці основні типи гібридизації — ідеалізоване уявлення, що стає точним лише при наявності відповідної симетрії. В загальному випадку співвідношення між атомними орбіталями в складі молекулярних орбіталей та кути між хімічними зв'язками дещо відрізнятимуться від ідеальних значень.
Джерела
- Ластухін Ю. О., Воронов С. А. Органічна хімія : підручник. — Вид. 3-тє, стереотипне. — Львів : Центр Європи, 2006. — С. 45-50. — ISBN 966-7022-19-6.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Гибридизация атомных орбиталей // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Сов. энцикл., 1988. — Т. 1 : Абляционные материалы — Дарзана реакция. — Стб. 1065. — Библиогр. в конце ст. — ISBN 5-85270-008-8.(рос.)