Фрагмент, здатний до кристалізації (Fc)
Фрагмент, здатний до кристалізації (Fc-область) є хвостовою областю антитіла, яка взаємодіє з рецепторами клітинної поверхні, які називаються Fc-рецепторами, та деякими білками системи комплементу . Ця властивість дозволяє антитілам активувати імунну систему . У ізотипів антитілIgG, IgA і IgD Fc-область складається з двох ідентичних білкових фрагментів, отриманих з другої та третьої константних областей (доменів) важких ланцюгів антитіла. Fc-області IgM та IgE містять три константні домени важкої ланцюга (домени CH 2-4) у кожному поліпептидному ланцюзі[1][2]. Fc-області IgG несуть висококонсервативний сайт N-глікозилювання[3][4]. Глікозилювання фрагмента Fc має важливе значення для активності, опосередкованої рецепторами Fc[5]. N-глікани, приєднані до цього сайту, є переважно фукозильованими діантенними структурами складного типу. Крім того, невеликі кількості цих N-гліканів також містять розщеплюючі GlcNAc та залишки сіалової кислоти, у положенні α-2,6.
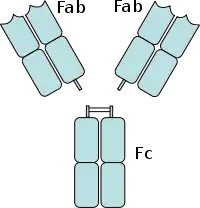
Інша частина антитіла, так звана область Fab, містить варіабельні ділянки, які визначають конкретну мішень, яку антитіло може зв'язувати. Навпаки, область Fc у всіх антитіл певного класу є однаковою для кожного виду; вони скоріше константні, а не мінливі. Тому область Fc іноді неправильно називається «областю константного фрагмента».
Fc зв'язується з різними рецепторами клітин і білками комплементу. Таким чином, він опосередковує різні фізіологічні ефекти антитіл (виявлення опсонізованих частинок; лізис клітин; дегрануляція тучних клітин, базофілів та еозинофілів та інші процеси)[6].
Інжиніринг фрагментів Fc
У нових розробках в галузі терапії на основі антитіл було розроблено Fc-область імуноглобулінів, яка містить сайт, що зв'язує антиген[7]. Цей тип антиген-зв'язуючого фрагмента називається Fcab . Фрагменти Fcab можна вставити в повний імуноглобулін шляхом заміни області Fc, отримуючи, таким чином, біспецифичне антитіло (з областями Fab і Fcab, що містять чіткі сайти зв'язування). Ці біспецифічні моноклональні антитіла іноді називають mAb2[8].
Див. також
- Антитіла
- Область Fab
Примітки
- Janeway, CA, Jr. (2001). Immunobiology (вид. 5th). Garland Publishing. ISBN 978-0-8153-3642-6.
- Larsson, Lars-Inge (September 1988). Immunocytochemistry: Theory and practice. Crc Press. ISBN 978-0-8493-6078-7.
- Analysis of immunoglobulin glycosylation by LC-ESI-MS of glycopeptides and oligosaccharides. Proteomics 8 (14): 2858–2871. 2008. PMID 18655055. doi:10.1002/pmic.200700968. Проігноровано невідомий параметр
|vauthors=(довідка) - A close look at human IgG sialylation and subclass distribution after lectin fractionation. Proteomics 9 (17): 4143–4153. 2009. PMID 19688751. doi:10.1002/pmic.200800931. Проігноровано невідомий параметр
|vauthors=(довідка) - Antibody fucosylation differentially impacts cytotoxicity mediated by NK and PMN effector cells. Blood 112 (6): 2390–2399. 2008. PMID 18566325. doi:10.1182/blood-2008-03-144600. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - Paul, William (2013). Fundamental Immunology (вид. Seventh). Lippincott Williams & Wilkins. с. 1401–142. ISBN 978-1451117837. Процитовано 31 грудня 2015.
- Introducing antigen-binding sites in structural loops of immunoglobulin constant domains: Fc fragments with engineered HER2/neu-binding sites and antibody properties. Protein Eng Des 23 (4): 289–297. 2010. PMID 20150180. doi:10.1093/protein/gzq005. Проігноровано невідомий параметр
|vauthors=(довідка); Проігноровано невідомий параметр|doi-access=(довідка) - Archived copy. Архів оригіналу за 8 липня 2013. Процитовано 13 серпня 2013.