Хлоратна кислота
Хлоратна кислота — HClO3, сильна одноосновна кислота, в якій хлор має ступінь окиснення +5. У вільному вигляді не отримана; у водних розчинах при концентрації нижче 30% на холоді досить стійка; в більш концентрованих розчинах розпадається:
- 8HClO3 = 4HClO4 + 3O2 + 2Cl2 + 2H2O
| Хлоратна кислота | |
|---|---|
 | |
 | |
| Ідентифікатори | |
| Номер CAS | 7790-93-4 |
| PubChem | 19654 |
| Номер EINECS | 232-233-0 |
| Номер EC | 232-233-0 |
| DrugBank | 14150 |
| KEGG | C01485 |
| ChEBI | 17322 |
| RTECS | CN9750000 |
| SMILES |
O=Cl(=O)O |
| InChI |
1/ClHO3/c2-1(3)4/h(H,2,3,4) |
| Номер Гмеліна | 1492 |
| Властивості | |
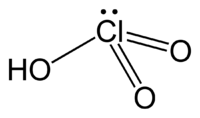
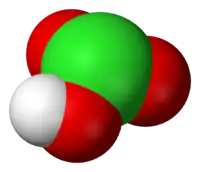
| Молекулярна формула | HClO3 |
| Молярна маса | 84,4591 г/моль |
| Зовнішній вигляд | безбарвний розчин |
| Густина | 1 г/мл, розчин (наближено) |
| Тпл | −20 °C(18% розчин) |
| Ткип | 40 °C (температура розкладу 18% розчину) |
| Розчинність (вода) | >40 г/100 мл (20 °C) |
| Кислотність (pKa) | ca. −1 |
| Структура | |
| Геометрія | тригонально-пірамідальна |
| Небезпеки | |
| ГГС піктограми |   |
| ГГС формулювання небезпек | Danger |
| R-фрази | 271, 314 |
| S-фрази | 210, 220, 221, 260, 264, 280, 283, 301+330+331, 303+361+353, 304+340, 305+351+338, 306+360, 310, 321, 363, 370+378, 371+380+375, 405, 501 |
| Головні небезпеки | Окисник, Кородуючий реагент |
| NFPA 704 |
 0
3
2
OX
|
| Пов'язані речовини | |
| Інші аніони | Йодатна кислота Броматна кислота |
| Інші катіони | Хлорат амонію Хлорат натрію Хлорат калію |
| Пов'язані речовини | Хлоридна кислота Гіпохлоритна кислота Хлоритна кислота Перхлоратна кислота |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Хімічні властивості
Хлоратна кислота — сильний окиснювач; її окиснювальна здатність збільшується із зростанням концентрації та температури. HClO3 легко відновлюється до соляної кислоти
- HClO3 + 6HBr → HCl + 3Br2 + 3H2O
У слабокислому середовищі HClO3 відновлюється сірчистою кислотою H2SO3 до Cl-, але при пропусканні суміші SO2 і повітря крізь сильнокислий розчин, виходить диоксид хлору: 2HClO3 + H2SO3 → 2ClO2 + H2SO4 + H2O
Від 40%-ної хлоратної кислоти запалюється, наприклад, фільтрувальний папір.
Отримання
Хлоратна кислота утворюється при розкладанні хлорнуватистої кислоти, при електролізі розчинів хлоридів; в лабораторних умовах отримують при взаємодії хлорату барію з розведеної сірчаною кислотою:
- Ba (ClO3)2 + H2SO4 = BaSO4 + 2HClO3
Похідні хлоратної кислоти
Хлоратні кислоті відповідають солі — хлорати; з них найбільше значення мають хлорат натрію, калію (бертолетова сіль), кальцію і магнію. Солі хлоратної кислоти (хлорати) — сильні окисники, в суміші з відновниками вибухонебезпечні.
Джерела
- Nils Wiberg, Egon Wiberg, Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. 102 Auflage. de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Луцевич Д. Д. Довідник з хімії, Українські технології, Львів 2003, 420 ст.
Література
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.