Хлорат калію
Хлора́т ка́лію (бертолетова сіль, Ка́лій триоксохлора́т) — KClO3, калієва сіль хлоратної кислоти (HClO3).
| Хлорат Калію | |
|---|---|
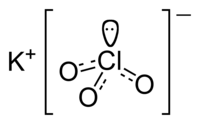 Структура іонів у хлораті калію | |
 Кристалічна структура хлорату калію | |
 Кристалічний хлорат калію | |
| Інші назви | Калію хлорат(V), Калій хлорнуватокислий, Бертолетова сіль |
| Ідентифікатори | |
| Номер CAS | 3811-04-9 |
| PubChem | 6426889 |
| Номер EINECS | 223-289-7 |
| RTECS | FO0350000 |
| SMILES |
[K+].[O-]Cl(=O)=O |
| InChI |
1/ClHO3.K/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1 |
| Властивості | |
| Молекулярна формула | KClO3 |
| Молярна маса | 122,5495 г/моль |
| Зовнішній вигляд | Білий кристалічний порошок |
| Густина | 2,34 г/см3 |
| Тпл | 356 °C |
| Ткип | 400 °C розкл. |
| Розчинність (вода) | 3,3 г/100 мл (0 °C) 7,3 г/100 мл (20 °C) 8,61 г/100 мл: (25 °C) 13,9 г/100 мл (40 °C) 23,8 г/100 мл (60 °C) 37,5 г/100 мл (80 °C) 57 г/100 мл (100 °C) [1] |
| Розчинність | слабко розчинний у гліцерині (1 г/100 г (20 °C)) розчинний в ацетоні, рідкому аміаку (2,52 г/100 г (0 °C))[2] |
| Показник заломлення (nD) | 1,40835 |
| Структура | |
| Кристалічна структура | моноклинна. При 257 °C переходить у ромбічну.[2] |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
−391 кДж·моль−1[3] |
| Ст. ентропія S |
143 Дж·моль−1·K−1[3] |
| Небезпеки | |
| ЛД50 | 1870 мг/кг (пацюки, перорально) |
| MSDS | ICSC 0548 |
| Індекс ЄС | 017-004-00-3 |
| Класифікація ЄС | |
| R-фрази | R9, R22, R51/53 |
| S-фрази | S2, S13, S16, S27, S61 |
| NFPA 704 |
 0
2
3
OX
|
| Температура спалаху | 400 °C |
| Пов'язані речовини | |
| Інші аніони | Бромат калію Йодат калію |
| Інші катіони | Хлорат амонію Хлорат натрію Хлорат барію |
| Пов'язані речовини | Хлорид калію Гіпохлорит натрію Хлорит калію Перхлорат калію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Історія
Вперше отримано Клодом Бертолле 1786 року при пропусканні хлору через гарячий концентрований розчин калій гідроксиду:
- 6KOH + 3Cl2 = KClO3 + 5KCl + 3H2O
Сучасний спосіб одержання калій хлорату в лабораторії мало відрізняється від винайденого К. Бертолле: газоподібний хлор пропускають крізь нагрітий до 70-80оС концентрований (приблизно 32 % мас.) розчин калій гідроксиду під тягою.[4]
Одержання
Промислове одержання калій хлорату відбувається через стадію диспропорціювання гіпохлоритів, які в свою чергу одержують взаємодією хлору з розчинами лугів:
- Cl2 + 2OH− ClO- + Cl− + H2O
- 3ClO− ClO-3 + 2Cl−
Технологічне оформлення процесу може бути різним. Один із способів полягає у переробці одного з найпоширеніших продуктів даної галузі промисловості — кальцій гіпохлориту, що входить до складу хлорного вапна. При нагріванні кальцій гіпохлорит диспропорціонує з утворенням кальцій хлорату:
- 3Ca(ClO)2 = Ca(ClO3)2 + 2CaCl2
Далі бертолетову сіль одержують проведенням реакції обміну між кальцій хлоратом і калій хлоридом, внаслідок якої калій хлорат, як найменш розчинна сіль у системі, випадає в осад:
- Ca(ClO3)2 + 2KCl = CaCl2 + 2KClO3
Юстус фон Лібіх запропонував спосіб, який полягає у пропусканні газоподібного хлору крізь нагріту суспензію кальцій гідроксиду з подальшим додаванням розчину калій хлориду для осадження бертолетової солі.[5]
Також хлорат калію отримують модифікованим методом Бертолле — електролізом гарячого концентрованого розчину хлориду калію без діафрагми. Процес проводять при температурах 40 —50 °C на графітових анодах і сталевих катодах.[6] Хлор, що утворюється при електролізі на аноді, вступає у взаємодію «in situ» («на місці», у момент виділення, «in statu nascendi») з гідроксидом калію з утворенням гіпохлориту калію, що далі диспропорціонує на калій хлорат і вихідний калій хлорид. Даний процес можна описати такими рівняннями.
- На катоді: 2H2O + 2e− = H2 + 2OH−
- На аноді: 2Cl− — 2e− = Cl2
- В розчині: 1) Cl2 + 2OH− = ClO− + Cl− + H2O
- 2) 3ClO− = ClO−3 + 2Cl−
Також на аноді може протікати електрохімічний процес утворення хлорату:
- 12ClO− + 12OH− — 12e− = 4ClO−3 + 8Cl− + 6H2O + 3O2
Серед побічних процесів, що протікають на електродах і зменшують практичний вихід хлорату, слід назвати перетворення молекул води або гідроксид-йонів на аноді з утворенням кисню, окиснення на аноді хлорату у перхлорат (ClO−3 + H2O − 2e− = ClO−4 + 2H+) та відновлення хлорат-йонів на катоді (ClO−3 + 3H2O + 6e− = Cl− + 6OH−). Вплив побічних процесів зменшують регулюванням температурного режиму процесу, рН електроліту, сили та густини електричного струму, а також підбором матеріалів, з яких виробляють електроди. Для зменшення долі відновлення хлорат-йонів на катоді, до складу електроліту вводять калій дихромат, який вступаючи в окисно-відновні взаємодії, створює на катоді плівку сполук хрому, що перешкоджає доступу хлорат-йонів до поверхні катоду.[7]
Хімічні властивості
При температурі ~ 400 °C розкладається з виділенням кисню з проміжним утворенням калій перхлорату:
- 4KClO3 = 3KClO4 + KCl (400 °C);
- KClO4 = KCl + 2O2↑ (550—620 °C)
У присутності каталізаторів (MnO2, Fe2O3, CuO тощо) температура розкладання значно знижується (до ~ 150-200 °C).
- 2KClO3 = 2KCl + 3O2 (150—300 °C, кат. MnO2).
Вважається, що процес при цьому відбувається через такі стадії:
- 2KClO3 + 6MnO2 2KCl + 6MnO3 2KCl + 6MnO2 + 3O2
Маса каталізатору становить від 5 до 100 % від маси бертолетової солі, взятої для досліду.[4]
У кристалічному стані бертолетова сіль проявляє властивості сильного окисника:
- KClO3 + 6HCl(конц.) = KCl + 3Cl2 + 3H2O
- 2KClO3 + 3S = 2KCl + 3SO2 (вище 130 °C)
- 10KClO3 + 12P(червоний) = 10KCl + 3P4O10 (вище 250 °C або при ударі і терті)[8]
Розплавлений калій хлорат енергійно підтримує горіння. Надзвичайно сильні окисні властивості бертолетової солі у розплавленому стані доводить реакція перетворення ферум(ІІІ) оксиду у ферат — до розплавленої суміші калій гідроксиду і калій хлорату додають порошок ферум(ІІІ) оксиду, при цьому з'являється червоно-фіолетове забарвлення ферату:
- Fe2O3 + KClO3 + 4KOH = 2K2FeO4 + KCl + 2H2O
Концентрованими сильними кислотами розкладається (диспропорціонує):
- 3KClO3 + 2H2SO4(конц.) = 2KHSO4 + 2ClO2 + KClO4 + H2O[8]
На відміну від хлоратної кислоти, водні розчини калій хлорату не проявляють сильних окисних властивостей, особливо у нейтральному і лужному середовищах.
Застосування
Вибухові речовини
Суміші хлорату калію з відновниками (фосфором, сіркою, органічними сполуками) є вибуховими і чутливі до тертя та ударів, чутливість підвищується у присутності броматів і солей амонію. Суміш червоного фосфору і бертолетової солі називається «суміш Армстронга» і застосовується у виробництві пістонів і хлопавок.[9]
Через високу чутливість сумішей інших речовин з бертолетовою сіллю до удару і тертя, вона практично не застосовуються для виробництва промислових і військових вибухових речовин. Відкриття Клодом Бертолле калій хлорату відбулось у часи, коли попит на селітру, як один із основних компонентів чорного пороху, був великим і ще зріс у зв'язку з початком буржуазної революції у Франції. Бертолле і Лавуазьє спробували замінити селітру на калій хлорат при виготовленні пороху. Перші випробування були проведені у Ессоні в 1788 році і призвели до загибелі 5 осіб. Ледве врятувався і сам Лавуазьє. Подальші дослідження особливих успіхів також не принесли.[10] Хоча рецептура виготовлення пороху з калій хлоратом як одним із компонентів існує, властивості цього пороху не дозволяють застосовувати його у великих масштабах.[11]
Іноді використовується в піротехніці як окисник та джерело хлору для сумішей, що горять кольоровим полум'ям (наприклад, сигнальних ракет). Входить до складу сірникової голівки (до 50 % за масою), і вкрай рідко використовується як ініціатор вибухових речовин (хлоратний порох — «сосіс», вогнепровідний шнур, також входив у склад підпалювальної суміші ручних гранат Вермахту).
В медицині
Деякий час розчини хлорату калію застосовувалися як слабкий антисептик та як зовнішній лікарський засіб для полоскання горла.[12]
Для одержання кисню
Певний час бертолетову сіль застосовували для лабораторного одержання чистого кисню, але внаслідок високої небезпеки її перестали застосовувати. При нагріванні до 400 °C одержували чистий кисень, але суміш нерідко вибухала. А кисень, утворений при каталітичному розкладанні бертолетової солі, міг бути забрудненим хлор діоксидом (до 3 % за об'ємом).[13]

Для отримання хлор діоксид
Реакція відновлення калій хлорату щавлевою кислотою при додаванні сульфатної кислоти використовується для отримання хлор діоксиду в лабораторних умовах.[4]
- 2KClO3 + H2C2O4 + H2SO4 = 2ClO2 + K2SO4 + 2CO2 + 2H2O
Цікаві факти
- Згоряння суміші бертолетової солі з алюмінієвою пудрою супроводжується яскравим спалахом. Значну частину світла такого спалаху становлять ультрафіолетові промені з довжиною хвилі близько 200 нм.[4]
- Вибухонебезпечність калій хлорату була відкрита самим Бертолле випадково і ледь не коштувала йому життя. Він розтирав у ступці порцію калій хлорату, а на стінках були залишки сірки, яку він розтирав до цього. Відбувся вибух — товкачик вирвало з рук Бертолле і він ледве не втрапив у голову вченого.
- Сленгова назва калій хлорату серед хіміків та піротехніків-любителів — «берта» — є скороченням від тривіальної назви «бертолетова сіль».
Примітки
- Solubility table (англ.)
- База данных физико-химических свойств и синтезов веществ (рос.)
- Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. с. A22. ISBN 0-618-94690-X.
- Рипан, Р. Руководство к практическим работам по неорганической химии (неметаллы): руководство / Р. Рипан, И. Четяну; пер. А. П. Исадченко; ред. В. И. Спицын. — М. : Мир, 1965. — 564 с. (рос.)
- Гринвуд Н. Химия элементов : в 2 т. / Н. Гринвуд, А. Эрншо; пер. с англ. В. А. Михайлова [и др.]. — Москва: Бином. Лаб. знаний, 2008. — Т. 2. — 2008. — 670 с. — ISBN 978-5-94774-374-6. (рос.)
- Барков С. А. Галогены и подгруппа марганца. Элементы VII группы периодической системы Д. И. Менделеева : пособие для учащихся / С. А. Барков. — М. : Просвещение, 1976. — 112 с.
- Методы получения хлоратов и перхлоратов (англ.)
- Лидин Р. А. Химические свойства неорганических веществ : [Учеб. пособие для вузов по направлению «Химия» и специальности «Неорган. химия»] / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева; Под ред. Р. А. Лидина. — 2-е изд., испр. — М. : Химия: Междунар. акад. изд. компания «Наука», 1997. — 479,[1] с. — ISBN 5-7245-1102-9. (рос.)
- Журнал «Химия и химики» 2013'1 — Бертолетова соль и красный фосфор ч.1 (рос.)
- Манолов К. Р. Великие химики: В 2-х т. / К. Манолов ; Перевод с болг. К. Манолова, С. Тасева; Под ред. [и с предисл.] Н. М. Раскина, В. М. Тютюнника. — 3-е изд., испр. и доп. — М. : Мир, 1985. — Т. 1. — М. : Мир, 1985. — 468 с. (рос.)
- Журнал «Химия и Химики» 2013'1 — Порох Бертолле (порох на основе хлората калия) ч.1
- Реми Г. Курс неорганической химии: в 2 т. / Пер. с нем., под ред. А. В. Новоселовой. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
- Гринвуд Н. Химия элементов : в 2 томах / Н. Гринвуд, А. Эрншо; пер. с англ. В. А. Михайлова [и др.]. — Москва: Бином. Лаб. знаний, 2008. — Т. 1. — 2008. — 607 с. — ISBN 978-5-94774-373-9. (рос.)
Посилання
- Potassium Chlorate from Bleach and Salt Substitute (англ.)
- Получение хлоратов и перхлоратов (рос.)
- Журнал «Химия и химики» 2012'1 (рос.)
- Журнал «Химия и химики» 2013'1 (рос.)
- База данных физико-химических свойств и синтезов веществ (рос.)
- Solubility table (англ.)
Джерела
- Барков С. А. Галогены и подгруппа марганца. Элементы VII группы периодической системы Д. И. Менделеева : пособие для учащихся / С. А. Барков. — М. : Просвещение, 1976. — 112 с. (рос.)
- Гринвуд Н. Химия элементов : в 2 томах / Н. Гринвуд, А. Эрншо; пер. с англ. В. А. Михайлова [и др.]. — Москва: Бином. Лаб. знаний, 2008. — Т. 1. — 2008. — 607 с. — ISBN 978-5-94774-373-9 (рос.)
- Гринвуд Н. Химия элементов : в 2 т. / Н. Гринвуд, А. Эрншо; пер. с англ. В. А. Михайлова [и др.]. — Москва: Бином. Лаб. знаний, 2008. — Т. 2. — 2008. — 670 с. — ISBN 978-5-94774-374-6 (рос.)
- Лидин Р. А. Химические свойства неорганических веществ : [Учеб. пособие для вузов по направлению «Химия» и специальности «Неорган. химия»] / Р. А. Лидин, В. А. Молочко, Л. Л. Андреева; Под ред. Р. А. Лидина. — 2-е изд., испр. — М. : Химия: Междунар. акад. изд. компания «Наука», 1997. — 479,[1] с. — ISBN 5-7245-1102-9(рос.)
- Манолов К. Р. Великие химики : В 2-х т. / К. Манолов ; Перевод с болг. К. Манолова, С. Тасева; Под ред. [и с предисл.] Н. М. Раскина, В. М. Тютюнника. — 3-е изд., испр. и доп. — М. : Мир, 1985. — Т. 1. — М. : Мир, 1985. — 468 с.(рос.)
- Реми Г. Курс неорганической химии: в 2 т. / Пер. с нем., под ред. А. В. Новоселовой. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
- Рипан Р. Руководство к практическим работам по неорганической химии (неметаллы) : руководство / Р. Рипан, И. Четяну; пер. А. П. Исадченко; ред. В. И. Спицын. — М. : Мир, 1965. — 564 с. (рос.)