ALAD
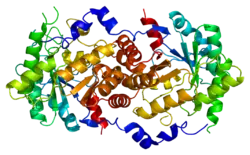
ALAD (англ. Aminolevulinate dehydratase) – білок, який кодується однойменним геном, розташованим у людей на короткому плечі 9-ї хромосоми.[3] Довжина поліпептидного ланцюга білка становить 330 амінокислот, а молекулярна маса — 36 295[4].
Послідовність амінокислот
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MQPQSVLHSG | YFHPLLRAWQ | TATTTLNASN | LIYPIFVTDV | PDDIQPITSL | ||||
| PGVARYGVKR | LEEMLRPLVE | EGLRCVLIFG | VPSRVPKDER | GSAADSEESP | ||||
| AIEAIHLLRK | TFPNLLVACD | VCLCPYTSHG | HCGLLSENGA | FRAEESRQRL | ||||
| AEVALAYAKA | GCQVVAPSDM | MDGRVEAIKE | ALMAHGLGNR | VSVMSYSAKF | ||||
| ASCFYGPFRD | AAKSSPAFGD | RRCYQLPPGA | RGLALRAVDR | DVREGADMLM | ||||
| VKPGMPYLDI | VREVKDKHPD | LPLAVYHVSG | EFAMLWHGAQ | AGAFDLKAAV | ||||
| LEAMTAFRRA | GADIIITYYT | PQLLQWLKEE |
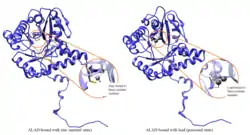
Кодований геном білок за функціями належить до ліаз, фосфопротеїнів. Задіяний у такому біологічному процесі, як альтернативний сплайсинг. Білок має сайт для зв'язування з іонами металів, іоном цинку.
Література
- Wetmur J.G., Bishop D.F., Cantelmo C., Desnick R.J. (1986). Human delta-aminolevulinate dehydratase: nucleotide sequence of a full-length cDNA clone.. Proc. Natl. Acad. Sci. U.S.A. 83: 7703 — 7707. PubMed DOI:10.1073/pnas.83.20.7703
- Wetmur J.G. (1991). RsaI polymorphism in the human delta-aminolevulinate dehydratase gene at 9q34.. Nucleic Acids Res. 19: 4307 — 4307. PubMed DOI:10.1093/nar/19.15.4307-a
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Gibbs P.N.B., Jordan P.M. (1986). Identification of lysine at the active site of human 5-aminolevulinate dehydratase.. Biochem. J. 236: 447 — 451. PubMed DOI:10.1042/bj2360447
- Wetmur J.G., Lehnert G., Desnick R.J. (1991). The delta-aminolevulinate dehydratase polymorphism: higher blood lead levels in lead workers and environmentally exposed children with the 1-2 and 2-2 isozymes.. Environ. Res. 56: 109 — 119. PubMed DOI:10.1016/S0013-9351(05)80001-5
- Jaffe E.K., Martins J., Li J., Kervinen J., Dunbrack R.L. Jr. (2001). The molecular mechanism of lead inhibition of human porphobilinogen synthase.. J. Biol. Chem. 276: 1531 — 1537. PubMed DOI:10.1074/jbc.M007663200
Примітки
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:395 (англ.). Процитовано 8 вересня 2017.
- UniProt, P13716 (англ.). Процитовано 8 вересня 2017.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.