Сигматропне перегрупування
Сигматро́пне перегрупува́ння (англ. sigmatropic rearrangements) — вид перициклічних реакцій, що здійснюється у вигляді міграції групи, яка пов'язана σ-зв’язком із кон'югованою π-електронною системою, з одного кінця цієї системи в інший. Така міграція супроводжується одночасним зсувом π-електронної густини. Сигматропні перегрупування є сугубо внутрішньомолекулярними реакціями.[1]
Назва цього виду реакцій походить від "Сигма", тобто класичного позначення насиченого зв'язку між двома атомами Карбону, й грецького слова "tropos" — шлях. Сигматропні перегрупування зазвичай протікають без каталізаторів, хоча кислоти Льюїса іноді можуть каталізувати ці процесси.
Номенклатура за Вудвардом–Гофманом
Згідно з цією номенклатурою, кожне конкретне перегрупування описується виразом : якщо, починаючи з розірваного сигма-зв'язку, рахувати атоми по обидві сторони розриву, то новий сигма-зв'язок утворюється між атомом номер з однієї сторони й атомом з іншої сторони.[2]
Нижче наведено короткий огляд можливих сигматропних реакцій:[3]
-sigmatropic_alkyl_shift.svg.png.webp) |
-sigmatropic_alkyl_shift.svg.png.webp) |
|---|---|
| [1,3]-Сигматропний зсув (R=H, алкіл) | [1,5]-Сигматропний зсув (R=H, алкіл) |
-sigmatropic_alkyl_shift.svg.png.webp) |
-Allyl_sulfoxide.svg.png.webp) |
| [1,7]-Сигматропний зсув (R=H, алкіл) | [2,3]-Сигматропне перегрупування
алілсульфоксиду |
-Ammonium_ylide.svg.png.webp) |
-Wittig.svg.png.webp) |
| [2,3]-Сигматропне перегрупування | [2,3]-Сигматропне перегрупування
алілоксикарбаніону (перегрупування Віттіга) |
-Cope_rearrangement.svg.png.webp) |
-Claisen_rearrangement.svg.png.webp) |
| [3,3]-Сигматропне перегрупування
1,5-гексадієну (перегрупування Коупа) |
[3,3]-Сигматропне перегрупування
алілвінілетеру (перегрупування Кляйзена) |
Стереохімія сигматропних перегрупувань
Топологія
Вудвард і Гофман запропонували формальне розділення реагуючої молекули на два радикальних фрагменти: мігруючий радикал (Гідроген, алкіл тощо) та радикал кон'югованої π-системи. Останньому можна присвоїти "площини" (англ. faces). У такому випадку, площина "супра" — це та площина, що містить орбіталь розірваного зв'язку; площина "антара" — це протилежна їй площина. Згідно такій номенклатурі, сигматропне перегрупування може проходити за двома сценаріями:
- Супрафасіальний (англ. suprafacial): новий зв'язок утворюється з тої ж площини, з якої був розірваний старий.
- Антарафасіальний (англ. antarafacial): старий зв'язок був розірваний з однієї площини, а новий утворюється з іншої.[4]
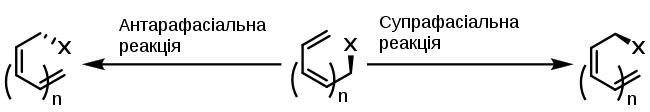
Якщо мігруюча група є Карбоновим центром, то можна умовно уявити, що мігруючий радикал має тригонально-біпірамідальну орієнтацію (подібно до карбокатіону); у такому випадку мігруючий фрагмент теж має свої площини. В залежності від того, з якої площини мігруючого фрагменту утворюється новий зв'язок, він може або утримувати свою конфігурацію ("утримання", англ. retention of configuration), або змінювати її ("інверсія", англ. inversion of configuration). Це можна проілюструвати на прикладі алкільної групи:

Якщо йдетьтся про [1, ]-перегрупування, то можна використовувати формулювання, наприклад, "супрафасіальний зсув з інверсією конфігурації", а якщо йдетьтся про [, ]-перегрупування, то доречніше казати "антара(фасіальне)-антара(фасіальне) перегрупування". Однак, для більшої лаконічності, [1, ]-зсуви можна описувати виразом типу "σ-антара-π-супра".[2]
Іноді, зміна конфігурації збігається зі зміною хіральної конфігурації. Однак, не всі мігруючі групи є хіральними, а також не всі випадки інверсії конфігурації супроводжуються інверсією хірального центру.
Метод граничних орбіталей
Оскільки сигматропні перегрупування не мають осі симетрії (навіть якщо її має перехідний стан, то вихідні сполуки й продукти все одно асиметричні), то їх не можна анілізувати за допомогою методу кореляції орбітальної симетрії.[2] Однак, метод граничних орбіталей дуже добре підходить для цієї задачі.
Згідно цього методу, радикал кон'югованої π-системи відображується у вигляді її ВЗМО (у випадку фотохімічної реакції це ВЗМО*). Таким чином, в залежності від того, чи потрібно мігруючому радикалу змінювати орбітальну фазу, можна визначити термічну чи фотохімічну дозволеність реакцій, а також чи зберігає атом у такому випадку свою конфігурацію:

Метод ароматичності перехідного стану
Цей метод також можна використовувати для аналізу дозволеності сигматропних перегрупувань. Таким чином, орбіталі π-системи мають бути представлені в основному стані; мігруючий сигма-фрагмент має пов'язувати кінці системи, між якими відбувається міграція. В залежності від того, чи має така система вузлову площину, її відносять або до системи Гюккеля, або до системи Мебіуса; якщо загальна кількість задіяних електронів (4n чи 4n+2) відповідає ароматичній системі, то таке перегрупування вважається термічно дозволеним:
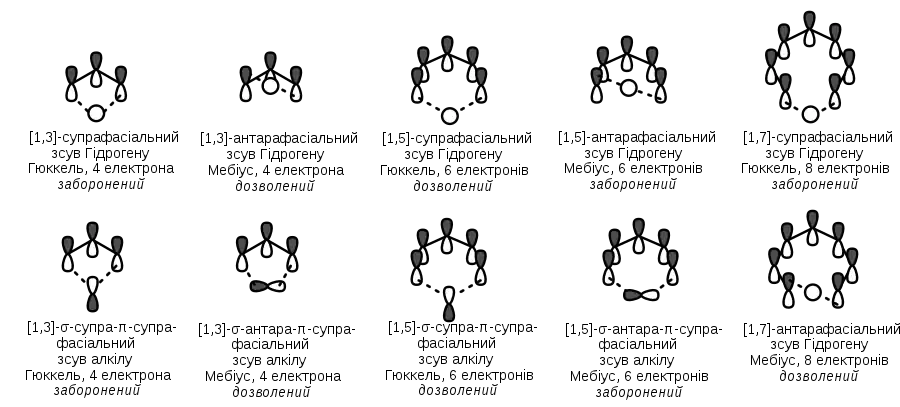
Загальні правила дозволеності сигматропних перегрупувань
Підсумовуючи, для сигматропних реакцій діють наступні правила орбітальної симетрії:[2][3]
| Кількість електронів | Режим реакції | Дозволеність реакцій | |
|---|---|---|---|
| Термічні | Фотохімічні | ||
| 4n | σ-супра-π-супра | Заборонена | Дозволена |
| σ-супра-π-антара | Дозволена | Заборонена | |
| σ-антара-π-супра | Дозволена | Заборонена | |
| σ-антара-π-антара | Заборонена | Дозволена | |
| 4n+2 | σ-супра-π-супра | Дозволена | Заборонена |
| σ-супра-π-антара | Заборонена | Дозволена | |
| σ-антара-π-супра | Заборонена | Дозволена | |
| σ-антара-π-антара | Дозволена | Заборонена | |
Walk rearrangements
"Крокуючі" сигматропні перегрупування (англ. walk rearrangements) — особливий випадок [1,]-супрафасіальних перегрупувань конденсованої біциклічної системи, що складається з (+1)-членного циклу й циклопропану:
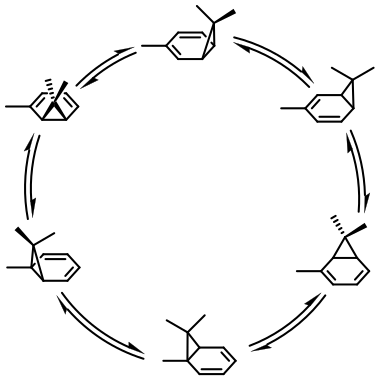
В залежності від порядку крокуючих перегрупувань, вони також можуть проходити з утриманням або інверсією конфігурації. Таким чином, наприклад, для термічних [1,3]-перегрупувань дозволена інверсія, а для [1,6]-перегрупувань — утримання:[5][2]
-walk_rearrangement_example.svg.png.webp)
-walk_rearrangement.svg.png.webp)
Див. також
Примітки
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Sankararaman, S. (Sethuraman), 1957- (2005). Pericyclic reactions : a textbook : reactions, applications, and theory. Weinheim: Wiley-VCH. ISBN 3-527-31439-3. OCLC 61439936.
- Carey, Francis A. (2013). Advanced Organic Chemistry : Part a: Structure and Mechanisms.. Springer. ISBN 978-1-4613-9795-3. OCLC 1059416763.
- Woodward, R. B.; Hoffmann, Roald (1969-11). The Conservation of Orbital Symmetry. Angewandte Chemie International Edition in English (англ.) 8 (11). с. 781–853. doi:10.1002/anie.196907811.
- Klärner, Frank-Gerrit; Glock, Volker; Figge, Helga (1986-03). Zum Mechanismus der Cyclopropan-„walk”-Umlagerung: Synthese und Eigenschaften von Diazoalkan-Addukten des 1,3-Cyclobutadiens. Chemische Berichte (нім.) 119 (3). с. 794–812. doi:10.1002/cber.19861190304.
