Цвітер-іон
Цві́тер-іо́н (англ. zwitterion, рос. цвиттер-ион) — це хімічна сполука, в молекулах якої є просторово розділені електричні формально одиничні протилежні заряди. Деякі хіміки наполягають на тому, що термін "цвітер-іон" повинен вживатися лише у випадку, коли заряди локалізовані на несуміжних атомах.[1] Інакше, повинен вживатися термін "ілід".[2] У цілому молекула є нейтральною.
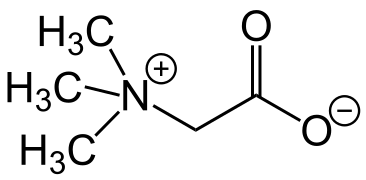
Такі сполуки виникають зокрема при внутрішньомолекулярному обміні протоном в амфотерних сполуках. Прикладами цвітер-іонів є амоніоацетат (гліцин) H3N+CH2C(=O)O–, триметилгліцин (CH3)3N+CH2C(=O)O–, триметиламіноксид (CH3)3N+–O–.
Триметилгліцин, або бетаїн, не може ізомеризуватися до незарядженої форми. Подібно, фосфонієві сполуки, що містять карбоксильні групи завжди зберігають розподіл зарядів і є цвітер-іонами.
Поведінка в залежності від pH середовища
Форма цвітер-іонної сполуки залежить від pH середовища. Залежно від pH середовища молекула буде приймати чи віддавати протон H+. Цвітер-іон перебуває в рівновазі з відповідними катіонними та аніонними формами. При pH нижче від pKa протонування, цвітер-іон перебуватиме в катіонній формі. При pH вище pKa депротонування, цвітер-іон перебуватиме в аніонній формі. Між цими двома величинами (при pH близькому до pI) молекула перебуватиме здебільшого в цвітер-іонній формі.
Це можна проілюструвати на прикладі амінокислоти гліцину. pKa протонування гліцину є 2,34, pKa депротонування — 9,6, відповідно, pI є 5,97.[3] Отже, при pH < 2,34 гліцин є позитивно зарядженим, при pH > 9,6 гліцин є негативно зарядженим. Між цими двома pH гліцин матиме і позитивний, і негативний заряд, тобто молекула буде в цвітер-іонній формі.
Аміно кислоти
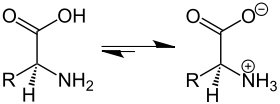
Амінокислоти у розчині перебувають у стані хімічної рівноваги між формою без зарядів і цвітер-іонною формою. Рівновага встановлюється у два етапи. Спершу протон карбоксильною групи переходить до молекули води утворюючи гідроксоній та залишаючи негативний заряд на амінокислоті:
Потім, протон гідроксонія переходить до аміно групи залишаючи молекулу води і утворюючи позитивний заряд на аміногрупі і приводячи загальний заряд молекули амінокислоти до нейтрального:
Загалом, реакція ізомеризації виглядає наступним чином:
Відношення концентрацій двох форм амінокислоти (незарядженої, [H2N(R)CO2H], і цвітер-іонної, [H3N+(R)CO2-]) у розчині є незалежним від pH середовища і відоме як константа рівноваги K реакції ізомеризації:
Зазвичай, K > 1, що значить, що цвітер-іонна форма є домінуючим ізомером у водному розчині. Пояснення запропоноване на базі теоретичного аналізу передбачає, що цвітер-іон стабілізується в водному середовищі за рахунок водневих зв'язків з молекулами розчинника (води).[4] Аналіз данних нейтронної дифракції гліцину вказує, що гліцин перебуває у цвітер-іонній формі в твердому стані, і підтверджує існування водневих зв'язків.[5] Теоретичні розрахунки вказують, що цвітер-іонна форма може бути присутня у деяких випадках в газовій фазі також.[6]
Бетаїни та подібні сполуки
Сполука триметилгліцин, що була ізольована з цукрового буряку, була названа "бетаїн". Пізніше, інші сполуки, що мали подібний структурний елемент (четвертинний атом нітрогену з карбоксильною групою приєднаною до нього через метиленовий місток -CH2-), були відкриті також. Наразі, усі сполуки, що містять цей структурний елемент узагальнено називаються бетаїнами. Бетаїни постійно перебувають в цвітер-іонній формі; ізомеризація до незарядженої форми не відбувається, або ж відбувається вкрай повільно.[7]
Іншими прикладами постійних цвітер-іонів є фосфатидилхоліни та псилоцибін, які також містять четвертинний атом нітрогену і негативно заряджену фосфатну групу замість карбоксильної; та легеневі сурфактанти такі як дипальмітоїлфосфатидилхолін.
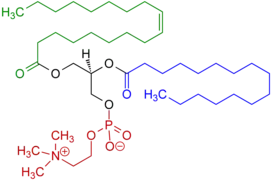 Приклад фосфатидилхоліну
Приклад фосфатидилхоліну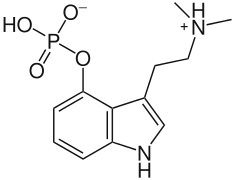
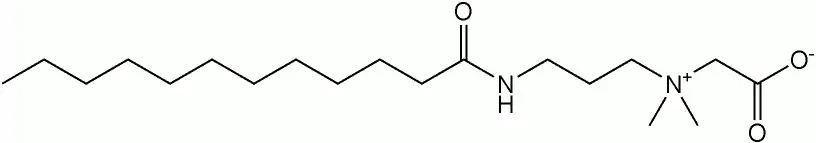 Лаурамідопропіл бетаїн, основний компонент кокамідопропіл бетаїну
Лаурамідопропіл бетаїн, основний компонент кокамідопропіл бетаїну
Інші сполуки
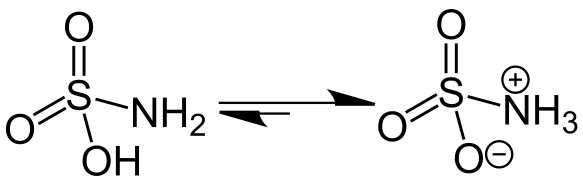 Ізомеризація сульфамінової кислоти з цвітер-іонною формою справа
Ізомеризація сульфамінової кислоти з цвітер-іонною формою справа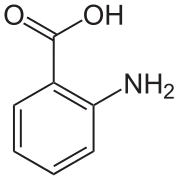 Антранілова кислота
Антранілова кислота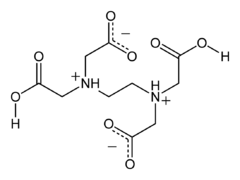 EDTA в цвітер-іонній формі
EDTA в цвітер-іонній формі
Сульфамінова кислота кристалізується в цвітеріонній формі.[8]
В кристалах антранілової кислоти дві молекули кислоти розміщені в елементарні комірці. Одна з молекул є в цвітер-іонній формі, а інша — в незарядженій формі.[9]
В твердому стані, EDTA існує в цвітер-іонній формі — два протони карбоксильних кислот є зміщені на атоми нітрогену.[10]
Застосування
Цвітер-іони можуть використовуватися у буферних розчинах. Утворення цвітер-іонів спостерігається під час синтезу деяких іонних рідин. Вони також входять до складу багатьох миючих засобів.
Через наявність точкових електричних зарядів цвітер-іони мають кращу розчинність у воді, ніж незареджена форма молекули. Тому багато активних фармацевтичних складників є саме у цвітер-іонній формі. Наприклад, цетиризин у препараті Зіртек.
Примітки
- zwitterionic compounds. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (англ.). Процитовано 27.09.2020.
- ylides. IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (англ.). Процитовано 27.09.2020.
- Chapter 27: Amino Acids, Peptides and Proteins. Organic Chemistry On-Line Learning Center, University of Calgary (англ.). Процитовано 27.09.2020.
- Jensen, Jan H.; Gordon, Mark S. (1995). On the Number of Water Molecules Necessary to Stabilize the Glycine Zwitterion. Journal of the American Chemical Society 117 (31): 8159–8170. doi:10.1021/ja00136a013.
- Jönsson, P.-G.; Kvick, Å. (1972). Precision neutron diffraction structure determination of protein and nucleic acid components. III. The crystal and molecular structure of the amino acid α-glycine. Acta Crystallographica Section B 28 (6): 1827–1833. doi:10.1107/S0567740872005096.
- Price, William D.; Jockusch, Rebecca A.; Williams, Evan R. (1997). Is Arginine a Zwitterion in the Gas Phase?. Journal of the American Chemical Society 119 (49): 11988–11989. PMC 1364450. PMID 16479267. doi:10.1021/ja9711627.
- Nelson, D. L.; Cox, M. M. (2000). Lehninger, Principles of Biochemistry (вид. 3rd). New York: Worth Publishing. ISBN 1-57259-153-6.
- Sass, R. L. (1960). A neutron diffraction study on the crystal structure of sulfamic acid. Acta Crystallographica 13 (4): 320–324.
- Brown, C. J.; Ehrenberg, M. (1985). Anthranilic acid, C7H7NO2, by neutron diffraction. Acta Crystallographica C 41 (3): 441–443. doi:10.1107/S0108270185004206.
- Cotrait, Par Michel (1972). La structure cristalline de l'acide éthylènediamine tétraacétique, EDTA [The crystalline structure of ethylenediamine tetraacetic acid, EDTA]. Acta Crystallographica B 28 (3): 781–785. doi:10.1107/S056774087200319X.
Джерела
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет — Донецьк: «Вебер», 2008. — 758 с. ISBN 978-966-335-206-0.
