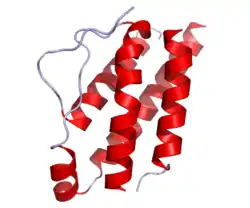
Інтерлейкін-2
IL2 (англ. Interleukin 2) — білок, який кодується однойменним геном, розташованим у людей на короткому плечі 4-ї хромосоми.[4] Довжина поліпептидного ланцюга білка становить 153 амінокислот, а молекулярна маса — 17 628[5].
Послідовність амінокислот
| 10 | 20 | 30 | 40 | 50 | ||||
|---|---|---|---|---|---|---|---|---|
| MYRMQLLSCI | ALSLALVTNS | APTSSSTKKT | QLQLEHLLLD | LQMILNGINN | ||||
| YKNPKLTRML | TFKFYMPKKA | TELKHLQCLE | EELKPLEEVL | NLAQSKNFHL | ||||
| RPRDLISNIN | VIVLELKGSE | TTFMCEYADE | TATIVEFLNR | WITFCQSIIS | ||||
| TLT |
Кодований геном білок за функціями належить до цитокінів, факторів росту. Задіяний у таких біологічних процесах як адаптивний імунітет, імунітет. Секретований назовні.
Література
- Fujita T., Takaoka C., Matsui H., Taniguchi T. (1983). Structure of the human interleukin 2 gene.. Proc. Natl. Acad. Sci. U.S.A. 80: 7437 — 7441. PubMed DOI:10.1073/pnas.80.24.7437
- Holbrook N.J., Lieber M., Crabtree G.R. (1984). DNA sequence of the 5' flanking region of the human interleukin 2 gene: homologies with adult T-cell leukemia virus.. Nucleic Acids Res. 12: 5005 — 5013. PubMed DOI:10.1093/nar/12.12.5005
- Chernicky C.L., Tan H., Burfeind P., Ilan J., Ilan J. (1996). Sequence of interleukin-2 isolated from human placental poly A+ RNA: possible role in maintenance of fetal allograft.. Mol. Reprod. Dev. 43: 180 — 186. PubMed DOI:10.1002/(SICI)1098-2795(199602)43:2<180::AID-MRD7>3.0.CO;2-N
- The status, quality, and expansion of the NIH full-length cDNA project: the Mammalian Gene Collection (MGC).. Genome Res. 14: 2121 — 2127. 2004. PubMed DOI:10.1101/gr.2596504
- Weir M.P., Chaplin M.A., Wallace D.M., Dykes C.W., Hobden A.N. (1988). Structure-activity relationships of recombinant human interleukin 2.. Biochemistry 27: 6883 — 6892. PubMed DOI:10.1021/bi00418a034
- Robb R.J., Kutny R.M., Panico M., Morris H.R., Chowdhry V. (1984). Amino acid sequence and post-translational modification of human interleukin 2.. Proc. Natl. Acad. Sci. U.S.A. 81: 6486 — 6490. PubMed DOI:10.1073/pnas.81.20.6486
Примітки
- Захворювання, генетично пов'язані з IL2 переглянути/редагувати посилання на ВікіДаних.
- Human PubMed Reference:.
- Mouse PubMed Reference:.
- HUGO Gene Nomenclature Commitee, HGNC:6001 (англ.). Процитовано 30 серпня 2017.
- UniProt, P60568 (англ.). Процитовано 30 серпня 2017.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.