Ацетанілід
Ацетанілід — органічна сполука з класу амідів. Формула . Біла тверда речовина.

| Структурна формула | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
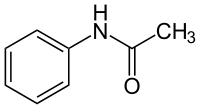 | |||||||||||||||||||
| Загальна інформація | |||||||||||||||||||
| Преференційна назва ІЮПАК | N-фенілетанамід | ||||||||||||||||||
| Систематична назва ІЮПАК | N-фенілацетамід | ||||||||||||||||||
| Інші назви |
Ацетанілід, ацетамінобензен | ||||||||||||||||||
| Хімічна формула | C8H9NO | ||||||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | ||||||||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||||||||
| |||||||||||||||||||
| Властивості | |||||||||||||||||||
| Молярна маса | 135,17 г/моль | ||||||||||||||||||
| Агрегатний стан |
Твердий | ||||||||||||||||||
| Зовнішній вигляд |
Біла тіерда речовина | ||||||||||||||||||
| Густина |
1,21 г/см3 (20 °C) | ||||||||||||||||||
| Температура плавлення |
114 °C | ||||||||||||||||||
| Температура кипіння |
305 °C | ||||||||||||||||||
| Температура самозаймання |
540 °C | ||||||||||||||||||
| pH розчину |
5 - 7 (25 °C, 10 г/л) | ||||||||||||||||||
| Розчинність |
6,1 г/л (25 °C) | ||||||||||||||||||
| Безпека | |||||||||||||||||||
| Маркування згідно системі УГС
Увага | |||||||||||||||||||
| H-фрази | H: H302 | ||||||||||||||||||
| P-фрази | P: P301+P312, P330 | ||||||||||||||||||
| LD50 |
800 мг/кг (щур, орально) | ||||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||||||||
Отримують взаємодією аніліну з ацетилюючими агентами: оцтовим ангідридом чи ацетилхлоридом.[1]
Вступає в реакції електрофільного заміщення в пара-положення до ацетиламіногрупи. Але електродонордий ефект цієї групи менший, ніж аміногрупи, але, на відміну від останньої, вона не окиснюється. Це застосовують для захисту аміногрупи під час реакцій нітрування.[2] Наприклад, для синтезу пара-нітроаніліну нітрують не анілін, а ацетанілід, а потім нітроацетанілід гідролізують.
Окрім нітрування, ацетанілід може вступати в реакції ацилювання (за допомогою хлороангідридів карбонових кислот)[3] і сульфування (за допомогою хлорсульфонової кислоти).[4] Продукт першої реакції (з хлороангідридом хлороцтової кислоти) використовується для синтезу барвників.[3]
Використовується для виробництва барвників, а також як стабілізатор і пластифікатор естерів целюлози.[1]
Примітки
- Kahl, Thomas; Schröder, Kai-Wilfrid; Lawrence, F. R.; Marshall, W. J.; Höke, Hartmut; Jäckh, Rudolf (15 червня 2000). У Wiley-VCH Verlag GmbH & Co. KGaA. Aniline. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a02_303. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a02_303.
- Ластухін Ю. О., Воронов С. А. Органічна хімія : підручник. — Вид. 3-тє, стереотипне. — Львів : Центр Європи, 2006. — ISBN 966-7022-19-6.
- Hunger, Klaus; Mischke, Peter; Rieper, Wolfgang; Raue, Roderich; Kunde, Klaus; Engel, Aloys (15 вересня 2000). У Wiley-VCH Verlag GmbH & Co. KGaA. Azo Dyes. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a03_245. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a03_245.
- Lindner, Otto; Rodefeld, Lars (15 вересня 2000). У Wiley-VCH Verlag GmbH & Co. KGaA. Benzenesulfonic Acids and Their Derivatives. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a03_507. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a03_507.
