Агрегатний стан
Агрегáтний стан — термодинамічний стан речовини, сильно відмінний за своїми фізичними властивостями від інших станів цієї ж речовини.
| Частина серії статей на тему: | ||||||||
| Термодинаміка | ||||||||
|---|---|---|---|---|---|---|---|---|
 Чотири фундаментальні агрегатні стани речовини | ||||||||
|
Розділи |
||||||||
|
||||||||
|
Властивості
|
||||||||
|
Властивості матерії
|
||||||||
|
Рівняння
|
||||||||
|
Історія
|
||||||||
|
| ||||||||
Загальний опис
Макроскопічний фiзичний стан, в якому знаходиться речовина при певних умовах — тиску, температурi.
Переходи між агрегатними станами однієї і тієї ж речовини супроводжуються стрибкоподібними змінами вільної енергії, ентропії, густини і інших фізичних властивостей. Як правило, серед агрегатних станів виділяють тверде тіло, рідину, газ та плазму. Відрізняються вони, в першу чергу, характером руху молекул та порядком симетрії. У випадку твердого стану розрізняють кристалічний та склоподібний. Кожний зі станів має свій ступінь впорядкованості, який визначається силами, що дiють мiж частинками.
Термін «агрегатний стан» досить розмитий, що часто дуже огрублює властивості речовини. Так, майже всі речовини в твердому агрегатному стані можуть мати, залежно від тиску і температури, декілька різних термодинамічних фаз. Відмінність поняття агрегатного стану речовини від термодинамічної фази полягає у виділеному вище слові «сильно». Як правило, вимагається, щоб агрегатні стани «виглядали» сильно по-різному. Термодинамічні ж фази можуть відрізнятися «непомітними оку» величинами, такими як теплоємність, структура кристалічних ґраток тощо. Проте при акуратному міркуванні рекомендується говорити саме у термінах термодинамічних фаз.
Чотири класичні агрегатні стани
Тверде тіло

У твердотільному стані речовина зберігає як форму, так і об'єм. При низьких температурах майже всі речовини замерзають — перетворюються в тверді тіла. Тверді тіла поділяють на кристалічні й аморфні.
З мікроскопічної точки зору тверді тіла характерні тим, що молекули або атоми в них впродовж довгого часу зберігають своє середнє положення незмінним, тільки здійснюючи коливання з невеликою амплітудою навколо них. У кристалах середні положення атомів чи молекул строго впорядковані. Кристалічні тіла зберігають не тільки ближній, а й дальній порядок. В аморфних тілах дальній порядок не зберігається, як і в рідинах.
Кристалічні тверді тіла мають анізотропні властивості, тобто їхній відгук на прикладені зовнішні сили залежить від орієнтації сил відносно кристалічних осей.
У твердотільному стані речовини можуть мати багато фаз, які відрізняються упорядкуванням атомів або іншими характеристиками, такими як упорядкування спінів у феромагнетиках.
Рідина
У рідкому стані речовина зберігає об'єм, але не тримає форму. Це означає, що рідина може займати тільки частину об'єму посудини, але вільно перетікати й проникати у всі її закутки. Рідина, на відміну від газу, має добре визначену поверхню. Для більшості речовин рідина — проміжний стан між газом і твердим тілом. Речовина переходить у рідкий стан із твердого в результаті процесу, який називається плавленням.
З мікроскопічної точки зору молекули рідини сильно взаємодіють між собою таким чином, що утворюють зв'язаний стан, тобто агрегуються. Потенціальна енергія їхнього притягання більша, ніж кінетична енергія теплового руху. Однак, на відміну від твердого тіла, молекули рідини достатньо рухливі, щоб часто змінювати своє положення. Рухаючись, молекули рідини в будь-який момент мають більш-менш упорядковане розташування, яке називають ближнім порядком, однак, цей порядок не строгий, і на далеких віддалях не зберігається.
Як і газ, рідини теж здебільшого ізотропні. Однак існують рідини із анізотропними властивостями — рідкі кристали. Крім ізотропної, так званої нормальної фази, ці речовини, мезогени, мають одну або кілька упорядкованих термодинамічних фаз, які називають мезофазами. Упорядкування у мезофазах відбувається завдяки особливій формі молекул рідких кристалів. Зазвичай це довгі вузькі молекули, яким вигідно укладатися так, щоб їхні осі збігалися.
Газ
Газоподібний стан характерний тим, що не зберігає ні форму, ні об'єм. Він заповнює весь доступний об'єм і проникає в будь-які його закутки. Це стан, властивий речовинам із малою густиною. Більшість речовин переходять у газоподібний стан з рідкого або твердого при підвищенні температури. Перехід із рідкого в газоподібний стан називають випаровуванням, а протилежний йому перехід із газоподібного стану в рідкий — конденсацією. Перехід із твердого стану в газоподібний, минаючи рідкий, називають сублімацією.
Деякі речовини не мають газоподібного стану. Це речовини зі складною хімічною будовою, які при підвищенні температури розпадаються внаслідок хімічних реакцій раніше, ніж стають газом.
З мікроскопічної точки зору газ — це стан речовини, в якому окремі її молекули взаємодіють слабо й рухаються хаотично. Взаємодія між ними зводиться до спорадичних зіткнень. Кінетична енергія молекул перевищує потенціальну.
Газу властива ізотропія, тобто незалежність характеристик від напрямку. Здебільшого, в звичних для людини земних умовах, газ має однакову густину в будь-якій точці, однак це не є універсальним законом, в зовнішніх полях, наприклад у полі тяжіння Землі, або в умовах різних температур густина газу може мінятися від точки до точки.
Не існує різних газоподібних термодинамічних фаз однієї речовини.
Плазма
.jpg.webp)
Плазма у фізиці — стан речовини, в якому її атоми іонізовані, тобто електрони відірвані від ядер. Завдяки цьому речовина стає не тільки електропровідною, але й надзвичайно чутливою до електромагнітних полів. Плазму називають четвертим агрегатним станом речовини на відміну від твердого, рідкого та газоподібного.
Плазма — високоіонізоване квазінейтральне суцільне середовище. На відміну від газу або рідини, в плазмі має місце далекосяжна кулонівська взаємодія між частинками, що і визначає її різноманітні властивості. Плазмові об'єкти у природі — зорі, планетарні туманності, верхні шари атмосфери — йоносфера. Штучно плазма створюється у тліючому газовому розряді, газорозрядних лампах, мас-спектрометрах, термоядерному синтезі, при роботі йонних двигунів, генераторів і т. д. Зокрема, плазму застосовують у термоелектронних і магнітоплазмодинамічних (МПД) генераторах — перетворювачах тепла безпосередньо в електричну енергію (минаючи перетворення в механічну).
Фазові переходи
Часто речовина при зміні температури і тиску переходить з одного агрегатного стану в інший різко, при деяких критичних значеннях цих параметрів. Таке перетворення називається фазовим переходом. Багато фазових переходів мають власні назви:
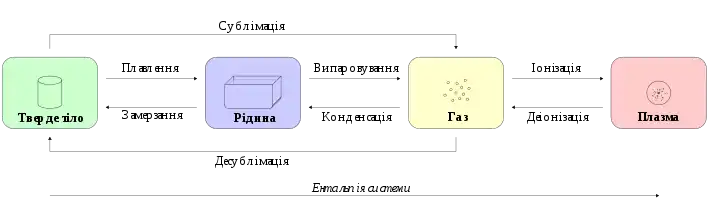
Фазові переходи поділяються на фазові переходу першого роду, при яких стрибкоподібно міняються перші похідні термодинамічних потенціалів по температурі і тиску, і фазові переходи другого роду, при якому різко міняються лише другі похідні. Переходи між агрегатними станами є фазовими переходами першого роду.
Низькотемпературні стани
Конденсат Бозе — Енштейна
При глибокому охолоджуванні, гази деяких (далеко не усіх) речовин переходять в стан конденсату Бозе — Ейнштейна. Деякі інші речовини при низьких температурах переходять в надпровідний або надтекучий стан. Будучи, безумовно, окремими термодинамічними фазами, цих станів навряд чи слід називати новими агрегатними станами речовини через їх неуніверсальність.
Ферміонний конденсат
Частинки з напівцілим спіном, тобто такі, що підкоряються статистиці Фермі, не можуть конденсуватися так, як часинки з цілим спіном. Проте, при достатньому охолоджені, такі частинки утворюють скорельовані пари, і ці пари починають поводити себе як частинки, що мають цілий спін. Це явище подібне до утворення куперівських пар, що є відповідальними за явище надпровідності. Ферміонну конденсацію було відкрито у 2004 році у лабораторіях NASA.[1]
Надплинне тверде тіло
Надплинне тверде тіло (англ. Supersolid) — стан речовини, що має ознаки одночасно твердого тіла і надплинної рідини. Однією з особливостей цього стану є переміщення дефектів у кристалі без тертя. Для створення таких систем, атоми охолодженого газу розміщують у максимумах стоячої хвилі, що рухається між двома дзеркалами. Цей стан був передбачений ще у 1969 році, проте надійно зафіксований — лише у 2017 році[2]
Інші стани
Вироджений газ
Стан, у який переходять гази при сильному охолодженні, або високому тиску. За таких умов принцип Паулі починає сильно впливати на здатність газу до стискання та інші його фізичні характеристики. В залежності від спіна, відрізняють вироджений фермі-газ і вироджений бозе-газ, властивості яких сильно відрізняються. Зазвичай, у такому стані знаходяться сукупності окремих частинок, тобто, говорять про вироджений електронний газ, вироджений нейтронний газ, тощо.[3]
Нейтронний стан
Принципово відмінний від інших стан речовини, яка складається тільки з нейтронів. У нейтронний стан речовина переходить при надвисокому тиску, недосяжному поки в лабораторії, але який існує всередині нейтронних зірок. При переході в нейтронний стан, електрони речовини об'єднуються з протонами і перетворюються на нейтрони. Для цього необхідно, щоб сили гравітації стиснули речовину настільки, щоб подолати відштовхування електронів, зумовлене принципом Паулі. В результаті, в нейтронному стані, речовина повністю складається з нейтронів і має густину порядку ядерної. Температура речовини при цьому не повинна бути дуже високою (в енергетичному еквіваленті, не більше від сотні МеВ).
Глазма
Стан матерії, що, ймовірно, виникає при зіткненнях високоенергетичних адронів, і передує утворенню кварк-глюонної плазми. Глазма є особливістю моделі конденсату кольорового скла, що описує сильну взаємодію за високих енергій. Можливим підтвердженням існування глазми є експерименти на Великому адронному колайдері, під час яких утворюються частинки, скорельовані за азимутальною швидкістю.[4]
Кварк-глюонна плазма
При сильному підвищенні температури (сотні МеВ і вище), в нейтронному стані починають народжуватися і анігілювати різноманітні мезони. При подальшому підвищенні температури, відбувається деконфайнмент, і речовина переходить в стан кварк-глюонної плазми. Вона складається вже не з адронів, а з кварків і глюонів, що постійно народжуються і зникають.
При подальшому необмеженому підвищенні тиску без підвищення температури речовина колапсує в чорну діру. При одночасному підвищенні і температури, до кварків і глюонів додаються інші частинки. Що відбувається з речовиною (а точніше, з речовиною + простором-часом) при температурах, близьких до планківської температури, поки невідомо.
Некласичні стани
Склоподібний стан
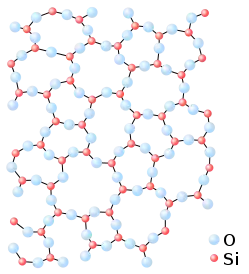
Скло — це некристалічний, або аморфний, твердий матеріал. Скло нерідко буває оптично прозорим, проте це не є загальною його характеристикою. Склоподібний стан, тобто, такий, при якому дальній порядок атомів не зберігається, може утворюватися при швидкому охолодженні речовини при переходженні її з рідкого стану в твердий стан. Деякі речовини, наприклад силікати, більш схильні до утворення аморфних станів.[5] Перехід з рідкого у склоподібний стан називається склуванням. Склування не є фазовим переходом — при ньому фізичні показники речовини змінюються поступово в залежності від температури.[6] Високомолекулярні полімерні сполуки, зазвичай, перебувають у склоподібному стані, через велетенський розмір своїх молекул (оргскло).
Рідкі кристали
Рідким кристалом називають стан речовини, у якому вона має властивості, проміжні між твердим і рідким — вони мають текучість, як рідини, проте зберігають далекий порядок а також анізотропію. Рідкі кристали, зазвичай, складаються з дуже довгих, або дископодібних молекул, що, через свою форму, не можуть вільно обертатися, що і зумовлює їх специфіку. Рідкі кристали демонструють незвичайні оптичні властивості, наприклад, зміну кольору під дією температури, завдяки чому знаходять застосування у багатьох галузях техніки.[7]
Високоеластичний стан
Властивий для полімерів стан, що є проміжним між склоподібним і рідким. Характерною особливістю цього стану є можливість значних (сотні відсотків) зворотних деформацій і дуже малий модуль пружності. Високоеластичний стан існує у проміжку температур, коли окремі ланки полімерів можуть переміщуватися одна відносно одної, проте цілі молекули не здатні цього зробити. При прикладені до матеріалу у такому стані сили, клубки полімерних ниток розплутуються, і витягуються в паралельні нитки, але при зникненні сили знову сплутуються. Цей зворотній рух має термодинамічні причини — ентропія сплутаних молекул є вищою ніж у розпрямлених, тому переходи у такі стани є більш ймовірними. Полімери, що знаходяться у високоеластичному стані називають еластомерами.[8]
Див. також
Речовини без визначеного агрегатного стану
Неоднорідні речовини типу паст, гелів, суспензій, аерозолів і т. д., які за певних умов демонструють властивості як твердих тіл, так і рідин і навіть газів, звичайно відносять до класу дисперсних матеріалів, а не до яких-небудь конкретних агрегатних станів речовини.
Примітки
- A New Form of Matter: II(англ.)
- Королев, Владимир. Физики впервые зафиксировали сверхтекучесть в твердом теле. nplus1.ru. Процитовано 8 грудня 2020.
- вырождения температура(рос.)
- Lead-proton collisions yield surprising results(англ.)
- Склоподібний стан речовини. Архів оригіналу за 3 лютого 2017. Процитовано 2 лютого 2017.
- ВИСОКОМОЛЕКУЛЯРНІ РЕЧОВИНИ ТА ЇХ РОЗЧИНИ. Архів оригіналу за 2 лютого 2017. Процитовано 2 лютого 2017.
- ХиМиК.ru - ЖИДКИЕ КРИСТАЛЛЫ - Химическая энциклопедия. xumuk.ru. Процитовано 8 грудня 2020.
- ВЫСОКОЭЛАСТИЧЕСКОЕ СОСТОЯНИЕ(рос.)
Джерела
- Гомонай В. І., Гомонай О. В. Фізична хімія. — Ужгород : Патент, 2004. — 712 с.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Кикоин А.К., Кикоин И.К. (1976). Молекулярная физика (російська). Москва: Наука.