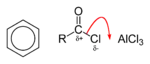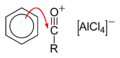Хлорангідриди карбонових кислот
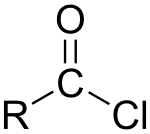
Хлорангідрид карбонової кислоти (ацилхлоридів) — похідне карбонової кислоти, в якій гідроксильна група -OH в карбоксильної групі -COOH замінена на атом хлору . Загальна формула R-COCl. Перший представник з R = H (хлористий форміл) не існує, хоча суміш CO і HCl в реакції Гаттермана - Коха поводиться подібно хлорангидридами мурашиної кислоти .
Номенклатура
Назва хлорангідрид походить від назв відповідних кислотних залишків (ацилів) шляхом додавання до них слова хлористий на початку або слова хлорид в кінці.
Фізичні властивості
Хлорангідриди це здебільшого рідини, киплять при значно нижчих температурах ніж відповідна кислота через відсутність міжмолекулярних водневих зв'язків . Наприклад, оцтова кислота кипить при 118 ° C, в той час як ацетилхлорид при 51 ° C. В ІЧ-спектрах хлорангідридів міститься, як і у інших карбонільних сполук, інтенсивна смуга поглинання при 1800 см-1.
Отримання
Отримують хлорангідриди найчастіше із взаємодії безводної карбонової кислоти з тіонілхлоридом (SOCl 2) [1], трихлоридистим фосфором (PCl 3) [2] або пятихлористого фосфором (PCl 5) [3], фосгеном (COCl 2) [4] .
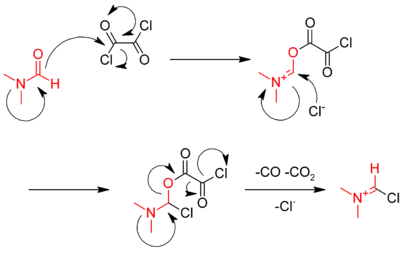
Ще один метод м'якого отримання хлорангидридов заснований на використанні оксалілхлорида
Є методи отримання хлорангидридов без виділення хлороводню, наприклад, реакція Аппеля .
або використовуючи ціанурхлорид [5]
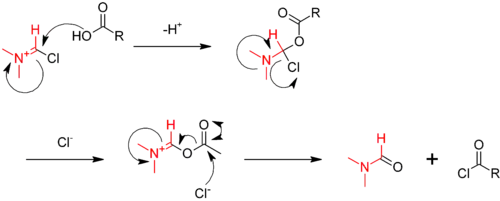
В реакції з тіонілхлоридом утворюються газоподібний діокис сірки і хлороводень, які легко видаляються з реакційної посудини, сприяючи проходженню реакції. Надлишок тіонілхлориду ( т.кіп. 79 ° C) легко видаляється на роторному випарнику . Механізм реакції для тіонілхлориду і пятихлористого фосфору схожі.
Реакція з оксалілхлорид каталізується диметилформамідом . На першій стадії утворюється іміневий интермедіат
Імініевая[Що?] сіль реагує з кислотою, відбираючи кисень і регенерує диметилформамід.
Реакції
Хлорангидріди хімічно виключно активні.
Нуклеофільні
Наявність кисню і хлору, сильних електроноакцепторів, при одному атомі вуглецю створює великий позитивний заряд на даному атомі, перетворюючи його таким чином в ціль нуклеофільних атак навіть для слабких нуклеофілів. Атом хлору є хорошою групою, що йде, що сприяє нуклефільному заміщення.
З водою нижчі хлорангидриди реагують надзвичайно енергійно, утворюючи відповідну карбонову кислоту і соляну кислоту:
Менш енергійно відбувається взаємодія зі спиртами
Аналогічно реагують Тіоли
Реакція з аміаком, первинними і вторинними амінами приводить до відповідних амідів :
Реакцією з солями карбонових кислот отримують ангідриди карбонових кислот
Також вони реагують з ціанідами
Застосування розчину лугу, піридину або надлишку аміну в даних реакціях бажано для видалення побічного продукту - хлороводню і каталізу реакції. Реакція карбонових кислот зі спиртами та амінами оборотна, що призводить до невисоких виходів. У той же час реакція з хлорангидридами швидка і незворотна, а їх синтез досить простий, що робить двохстадійний процес кращим.
З вуглецевими нуклеофілами такими як реактиви Гріньяра ацилхлоридів реагують високою швидкістю і утворенням кетонів. Використання надлишку реактиву Гріньяра призводить до отримання теоретичних спиртів. У той же час реакція з кадмійорганічними сполуками зупиняється на стадії утворення кетона. Аналогічним чином проходять реакції з реактивом Gilman (літій діметілмедь (CH 3) 2 CuLi). В цілому ароматичні ангідриди менш реакційноздатні та вимагають більш жорстких умов проведення реакції ніж алкільні. Хлорангідриди відновлюються такими сильними відновниками як літій алюміній гідрид або диізобутілалюміній гідрид з утворенням первинних спиртів. Літій трітретбутоксіалюміній гідрид, об'ємистий відновник, відновлює до альдегідів також як і в реакції Розенмунда - Зайцева воднем над «отруєному» паладіевим каталізатором.
Електрофільні
Хлорангідриди карбонових кислот в присутності кислот Льюїса ( хлорид заліза (III), хлорид алюмінію ) вступають в реакцію Фріделя-Крафтса з ароматичними сполуками, утворюючи ароматичні кетони .
Перша стадія - відщеплення атома хлору кислотою Льюїса
далі йде атака ароматичного з'єднання карбкатіоном
потім відбувається відщеплення водню з утворенням хлороводню, що звільняється хлорид алюмінію утворює комплекс з ароматичним кетоном по атому кисню
застосування
Завдяки високій реакційній здатності хлорангидріди широко застосовуються в органічному синтезі як ацилющого агента для введення в синтезируемую молекулу залишку карбонової кислоти ( ацильного група ).
Безпека
Через високу активність ацилхлоридів володіють загальною токсичністю, робота з ними повинна вестися з належною обережністю (захисний одяг, витяжна вентиляція). Ацилхлоридів проявляють лакриматорні властивості через гідролізу до хлороводню і карбонової кислоти на слизових оболонках очей і дихальних шляхів.
Див. також
Примітки
- Титце, Айхер Препаративная органическая химия М.:1999, стр. 128
- Титце, Айхер Препаративная органическая химия М.:1999, стр. 481
- Титце, Айхер Препаративная органическая химия М.:1999, стр. 159
- Ulrich, H.; Richter, R. 4-Isocyanatophthalic Anhydride. A Novel Difunctional Monomer, Journal of Organic Chemistry 1973, 38, 2557
- K. Venkataraman, and D. R. Wagle (1979). «Cyanuric chloride : a useful reagent for converting carboxylic acids into chlorides, esters, amides and peptides». Tetrahedron Letters 20 (32): 3037-3040