Бета-галактозидаза
Бета-галактозидаза, або β-галактозидаза, фермент, глікозидна гідролаза, каталізує гідроліз β-галактозидів на моносахариди шляхом розщеплення глікозидного зв'язку. β-галоктозидами (субстратами для цього ферменту) є вуглеводи, що містять галактозу як один із фрагментів. Субстратами різних бета-галактозидаз є гангліозиди, GM1, лактозилцераміди, лактоза, та різноманітні глікопротеїни.[1]
| β-галактозидаза | |
|---|---|
.png.webp) | |
| Ідентифікатори | |
| Символ | β-gal, lacZ |
| Номер CAS | |
| PDB | https://www.ebi.ac.uk/thornton-srv/databases/cgi-bin/enzymes/GetPage.pl?ec_number=3.2.1.23 |
| Інша інформація | |
Властивості та функції
β-галактозидаза є екзоглікозилазою, яка гідролізує β-глікозидний місток, утворений галактозою. Вона також розщеплює фукозиди та арабінозиди, але з меншою ефективністю. Це важливий білок в людському організмі. Дефіцит ферменту може спричинити галактозиалідоліз, або синдром Morquio B. В E. coli, ген β-галактозидази (ген lacZ) присутній як частина регульованої системи лактозного оперону, який активується за відсутності глюкози та за наявності лактоза як єдиного поживного цукру.
У бета-галактозидази є багато гомологів, що представлені подібними поліпептидними послідовностями. Бета-галактозидаза інгібується L-рибозою, неконкурентно інгібується йодом, конкурентно інгібується D-галактолактоном, IPTG та галактозою.[2]
Структура
β-галактозидаза довжиною 1024 амінокислоти з E. coli була секвенована в 1970 році,[3] а її просторова структура була визначена в 1994 році. Білок представляє собою гомотетрамер вагою 464-кДа, що володіє точковою симетрією 2,2,2.[4] Кожна одиниця β-galactosidase складається з п'яти доменів.
Третій домен містить активний сайт.[5] Активний сайт утворений амінокислотними залишками з двох білків з тетрамеру, при цьому дисоціація тетрамеру на димери руйнує активний сайт. Термінальні амінокислоти білку відповідають за альфа-комплементацію.
Реакція
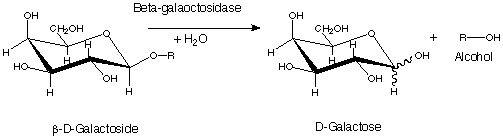
β-галатозидаза в організмах може каталізувати дві різні реакції. В одній з них вона проходить через трансглікозилювання, утворюючи аллолактозу, що створює позитивний зворотній зв'язок в синтезі β-галактозидази. В другій реакції бета-галактозидаза гідролізує лактозу до галактози та глюкози, які є вихідними речовинами для гліколізу.[6]
Ензиматична реакція гідролізу лактози складається з двох хімічних стадій, галактозилювання (k2) та дегалактозилювання (k3). Галактозилювання це перша стадія, в якій Glu461 донує протон на глікозидний атом кисню, після чого залишок галактози ковалентно приєднується до Glu537. На другій стадії, дегалактозилюванні, цей ковалентний зв'язок зникає коли Glu461 приймає протон назад, заміняючи галактозу на воду. Утворюються два перехідних стани в каталітичному центрі ензиму, один на кожну стадію. Одна молекула бета-галактозидази каталізує 38,500 ± 900 перетворень на хвилину.[6] Моновалентні іони калію(K+) а також дивалентні іони магнію (Mg2+) необхідні для правильного функціонування ензиму.
Застосування
β-галактозидазний тест використовується в генетиці та молекулярній біології. Активний білок може бути детектований за допомогою хімічної сполуки X-gal, яка розщєплюється β-галактозидазою, утворюючи нерозчинний яскраво-синій барвник. Ця сполука використовується також у біло-синьому скринінгу.[7] Експресія ензиму в бактеріях може бути активована за допомогою хімічних аналогів лактози, таких як IPTG, який зв'язується з лактозним репресором, активуючи синтез білків з лактозного оперону.
Таким чином бета-галактозидаза є популярним геном-репортером в дослідженнях експресії генів завдяки явищу, відомому як α-комплементарність. Ензим може бути розділений на два поліпептиди, LacZα та LacZΩ, жоден з яких не може каталізувати реакцію гідролізу поодинці, але які спонтанно утворюють каталітично активний ензим, коли присутні у клітині одночасно. Ця властивість використовується у створенні векторів для клонування, коли наявність плазмідного lacZα гену в LacZΩ-штамах E. coli буде обумовлювати синій колір колоній. В той же час, вставка рекомбінантної ДНК в плазміду унеможливлює продукування LacZα, що обумовлює білий колір колоній. Бета-галактозидазна репортерна система також використовувалась в мишах.[8]
Посилання
- Dorland's Illustrated Medical Dictionary Архівовано 16 жовтня 2006 у Wayback Machine..
- Juers, Douglas H.; Hakda, Shamina; Matthews, Brian W.; Huber, Reuben E. (2003-11-01).
- Fowler AV, Zabin I (October 1970). «The amino acid sequence of beta galactosidase. I. Isolation and composition of tryptic peptides». J. Biol. Chem. 245 (19): 5032–41. PMID 4918568.
- Jacobson, R. H.; Zhang, X. -J.; Dubose, R. F.; Matthews, B. W. (1994). «Three-dimensional structure of β-galactosidase from E. Coli». Nature 369 (6483): 761—766. doi:10.1038/369761a0. PMID 8008071.
- Matthews BW (June 2005). «The structure of E. coli beta-galactosidase». C. R. Biol. 328 (6): 549–56. doi:10.1016/j.crvi.2005.03.006. PMID 15950161.
- Juers, Douglas H.; Matthews, Brian W.; Huber, Reuben E. (2012-12-01).
- Beta-Galactosidase Assay (A better Miller) - OpenWetWare
- Dobson, C. L.; Warren, A. J.; Pannell, R.; Forster, A.; Rabbitts, T. H. (2000).