Вірус гепатиту C
Вірус гепатиту C (англ. hepatitis C virus (HCV)) — невеликий одноланцюговий позитивно спрямований РНК-вмісний вірус родини Flaviviridae. Є збудником вірусного гепатиту C, при якому часто розвивається окрім гепатиту ще й широкий спектр уражень інших органів і систем, насамперед цироз печінки і гепатоцелюлярну карциному.
Таксономія
? Hepatitis C virus / вірус гепатиту C | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
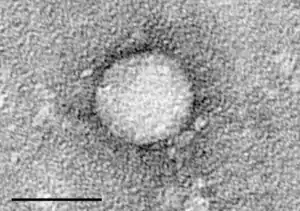 Електронна мікрофотографія вірусу C, очищеного з клітинної культури. | ||||||||||
| Класифікація вірусів | ||||||||||
| ||||||||||
| Синоніми | ||||||||||
| Вірус гепатиту C, Hepatitis C virus | ||||||||||
Посилання | ||||||||||
| ||||||||||
Вірус належить до роду Hepacivirus. Один вид цього роду був виявлений у собак: собачий гепацивірус. У цьому роду також є принаймні один вид, який уражає коней. Кілька видів описано у кажанів і гризунів. Ізоляти вірусу згруповані в сім генотипів і ряд підтипів із чітким географічним розподілом і чутливістю до лікування на основі інтерферону.
Структура
Частка вірусу гепатиту С складається з ліпідної оболонки. Два глікопротеїни вірусної оболонки, E1 (E1) і E2 (E2), вбудовані до неї. E1 і E2 ковалентно зв'язані, коли вони вбудовуються в оболонку вірусу, і стабілізуються дисульфідними зв'язками. E2 має кулясту форму і, за даними спостереження при електронній мікроскопії, виступає на 6 нм із мембрани оболонки. Ці глікопротеїни відіграють важливу роль у взаємодії вірусу гепатиту С з імунною системою людини. На глікопротеїні E2 є гіперваріабельна ділянка. Вона є гнучкою і цілком доступною для навколишніх молекул. Допомагає E2 захистити вірус від імунної системи, запобігає причепленню CD81 до відповідного рецептора вірусу. Крім того, Е2 може захистити і Е1 від імунної системи. Хоча цю ділянку складає досить варіабельна амінокислотна послідовність, гіперваріабельна ділянка має схожі хімічні, фізичні та конформаційні характеристики для багатьох E2 глікопротеїнів.
Геном
Геном складається з однієї відкритої рамки зчитування, яка завдовжки у 9600 нуклеотидних основ. Ця єдина відкрита рамка зчитування перетворюється на отримання єдиного білкового продукту, який згодом обробляється для отримання менших активних білків. Через це в загальнодоступних вірусних базах даних вірусний протеом складається лише з 2 білків. На 5′ і 3′ кінцях РНК знаходяться нетрансльовані ділянки, які не транслюються в білки, але важливі для трансляції та реплікації вірусної РНК. 5′ кінець має сайт зв'язування рибосоми, який ініціює трансляцію дуже протяжного білка, що містить близько 3000 амінокислот. Основний домен HCV IRES (Hepatitis C virus internal ribosome entry site) містить чотиристоронню гвинтову структуру Холлідея, яка інтегрована у передбачений псевдовузол (pseudoknot). Конформація цього основного домену обмежує орієнтацію відкритої рамки зчитування для позиціонування на рибосомній субодиниці 40S. Великий білок-попереднік пізніше розщеплюється клітинними та вірусними протеазами на 10 менших білків, які забезпечують реплікацію вірусу в клітині-хазяїні або збираються у зрілі вірусні частинки. Структурні білки, що виробляються вірусом гепатиту С, включають коровий білок (HCVcor), Е1 і Е2. Неструктурні білки включають NS2, NS3, NS4A, NS4B, NS5A і NS5B. На виявленні антитіл до них частково ґрунтується серологічна діагностика гепатиту C.
Молекулярна біологія
Білки вірусу гепатиту C розташовані вздовж генома в такій послідовності: N-термінальна оболонка-ядро-оболонка (E1)–E2–p7-неструктурний білок 2 (NS2)–NS3–NS4A–NS4B–NS5A–NS5B–C кінцевий. Покоління зрілих неструктурних білків (NS2 — NS5B) залежить від активності вірусних протеїназ. З'єднання NS2/NS3 розщеплюється металзалежною автокаталітичною протеїназою, що кодується всередині NS2 та N-кінця NS3. Решта розщеплення каталізуються сериновою протеазою, яка також міститься в N-кінцевій області NS3.
Основний білок містить 191 амінокислоту і за гідрофобністю його можна розділити на три домени:
- домен 1 (залишки 1–117) містить переважно основні залишки з двома короткими гідрофобними ділянками;
- домен 2 (залишки 118—174) менш основний і більш гідрофобний, а його С-кінець знаходиться на кінці p21;
- домен 3 (залишки 175—191) дуже гідрофобний і діє як сигнальна послідовність для білка оболонки E1.
Обидва білки оболонки (E1 і E2) високоглікозильовані, є важливими для проникнення в клітину. E1 є фузогенною субодиницею, а E2 діє як білок, що зв'язує рецептор. E1 має 4–5 N-зв'язаних гліканів, а E2 — 11 сайтів N-глікозилювання.
Білок NS1 (p7), необхідний для реплікації вірусного геному, відіграє вирішальну роль у морфогенезі вірусу. Цей білок складається з 63 амінокислот, що охоплюють мембрану, яка розташовується в ендоплазматичній мережі. Розщеплення p7 опосередковується сигнальними пептидазами ендоплазматичної мережі. Два трансмембранних домени (transmembrane domain) р7 з'єднані цитоплазматичною петлею і орієнтовані в бік просвіту ендоплазматичної мережі.
Білок NS2 є трансмембранним білком масою 21–23 кДа, з протеазною активністю.
NS3 є білком масою 67 кДа, N-кінець якого має активність серинової протеази, а С-кіненць має активність НТФази/гелікази. Він розташований всередині ендоплазматичного ретикулума і утворює гетеродимерний комплекс із NS4A — мембранним білком із 54 амінокислот, який діє як кофактор протеїнази.
NS4B є невеликим (27 кДа) гідрофобним інтегральним мембранним білком із чотирма трансмембранними доменами. Він міститься всередині ендоплазматичної сітки і відіграє важливу роль у залученні інших вірусних білків. Спричинює морфологічні зміни в ендоплазматичному ретикулумі, утворюючи структуру — мембранну павутину.
NS5A є гідрофільним фосфопротеїном, який відіграє важливу роль у реплікації вірусу, модуляції клітинних сигнальних шляхів та інтерферонової відповіді. Виявлено, що він зв'язується з білками VAP людини, закріпленими на ендоплазматичному ретикулумі.
Білок NS5B (65 кДа) являє собою вірусну РНК-залежна РНК-полімеразу. Виконує ключову функцію реплікації вірусної РНК ВГС, використовуючи позитивний ланцюг РНК вірусу як свою матрицю, і каталізує полімеризацію рибонуклеозидтрифосфатів під час реплікації РНК. Декілька кристалічних структур полімерази NS5B у кількох кристалічних формах було визначено на основі однієї консенсусної послідовності HCV-BK, генотип 1. Конструкція може бути представлена формою правої руки з пальцями, долонею та великим пальцем. Активний центр, унікальний для NS5B, міститься в структурі долоні білка. Нещодавні дослідження структури білка NS5B генотипу 1b штаму J4 (HC-J4) вказують на наявність активного центру, де можливий контроль зв'язування нуклеотидів та ініціація синтезу нової РНК. Додає необхідні праймери для ініціації реплікації РНК. Сучасні дослідження намагаються зв'язати структури з цим активним сайтом, щоб змінити його функціональність, щоб запобігти подальшій реплікації вірусної РНК.
Описаний 11-й білок, який кодується зсувом рамки +1 в гені капсида. Його функція достеменно невідома.
Примітки
Джерела
- Dubuisson, Jean; Cosset, François-Loïc (2014). «Virology and cell biology of the hepatitis C virus life cycle — An update». Journal of Hepatology. 61 (1): S3–S13. doi:10.1016/j.jhep.2014.06.031. PMID 25443344. (англ.)
- Genus: Hepacivirus (англ.)
- Kato N (2000). «Genome of human hepatitis C virus (HCV): gene organization, sequence diversity, and variation». Microb. Comp. Genom. 5 (3): 129–51. doi:10.1089/mcg.2000.5.129. PMID 11252351 (англ.)
- Sanjiv Chopra Characteristics of the hepatitis C virus. UpToDate Sep 14, 2021. (англ.)
Посилання
- Hepatitis C virus (англ.)