Дигідрофосфат калію
Дигідрофосфат калію (також монокалію фосфат, MKP, KDP або одноосновний фосфат калію) — неорганічна сполука з формулою KH2PO4. Разом з дикалій фосфатом (K2HPO4.(H2O)x) його часто використовують як добриво, харчову добавку та буферний агент. Сіль часто співкристалізується з двокалієвою сіллю, а також з ортофосфатною кислотою.[4]
| Дигідрофосфат калію | |
|---|---|
 | |
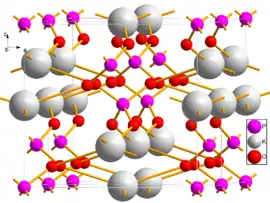 Дві елементарні комірки дигідрофосфату калію, розглянуті поблизу осі b | |
| Назва за IUPAC | Дигідрофосфат калію Дигідроген(тетраоксидофосфат)(1−) калію |
| Систематична назва | Дигідроксиддіоксидофосфат(1−) калію |
| Інші назви | Фосфат калію одноосновний; Монокалієва сіль ортофосфатної кислоти; Біфосфат калію |
| Ідентифікатори | |
| Номер CAS | 7778-77-0 |
| PubChem | 516951 |
| Номер EINECS | 231-913-4 |
| DrugBank | 09413 |
| ChEBI | 63036 |
| RTECS | TC6615500 |
| SMILES |
[K+].OP(O)([O-])=O |
| InChI |
InChI=1S/K.H3O4P/c;1-5(2,3)4/h;(H3,1,2,3,4)/q+1;/p-1 |
| Номер Бельштейна | 15935277 |
| Властивості | |
| Молекулярна формула | KH2PO4 |
| Молярна маса | 136,086 г/моль |
| Зовнішній вигляд | Білий порошок, розріджений |
| Запах | Без запаху |
| Густина | 2,338 г/см3 |
| Тпл | 252,6 °C |
| Ткип | 400 °C, розкладається |
| Розчинність (вода) | 22,6 г/100 мл (20 °C) 83,5 г/100 мл (90 °C) |
| Розчинність | Малорозчинний в етанолі |
| Кислотність (pKa) | 6,86[1] |
| Основність (pKb) | 11,9 |
| Показник заломлення (nD) | 1,4864 |
| Структура | |
| Кристалічна структура | Тетрагональна[2] |
| I42d | |
| Небезпеки | |
| ЛД50 | 3200 мг/кг (щури, орально) |
| ГГС піктограми |  [3] [3] |
| ГГС формулювання небезпек | 315, 319 |
| ГГС запобіжних заходів | 264, 280, 305+351+338, 321, 332+313, 337+313 |
| NFPA 704 |
 0
1
0
|
| Температура спалаху | Негорючий |
| Пов'язані речовини | |
| Інші катіони | Фосфат мононатрію Дигідрофосфат амонію |
| Пов'язані речовини | Фосфат дикалію Фосфат трикалію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Монокристали параелектричні при кімнатній температурі. При температурах нижче -150 °C вони стають сегнетоелектричними.
Структура
Дигідрофосфат калію може існувати в декількох поліморфах. При кімнатній температурі він утворює параелектричні кристали з тетрагональною симетрією. При охолодженні до −150 °C він перетворюється на сегнетоелектричну фазу ромбічної симетрії, і температура переходу зміщується до −50 °C, коли водень замінюється дейтерієм.[5] Нагрівання до 190 °C змінює його структуру на моноклінну.[6] При подальшому нагріванні дигідрофосфат калію розкладається внаслідок втрати води до метафосфату калію KPO3 при 400 °C.
| Симетрія | Просторова група |
№ | Символ Пірсона |
a (нм) |
b (нм) |
c (нм) |
Z | Густина (г/см3) |
T (°C, °F, K) |
|---|---|---|---|---|---|---|---|---|---|
| Орторомбічна[5] | Fdd2 | 43 | oF48 | 1,0467 | 1,0533 | 0,6926 | 8 | 2,37 | < −150 °C, −238 °F, 123 K |
| Тетрагональна[2] | I42d | 122 | tI24 | 0,744 | 0,744 | 0,697 | 4 | 2,34 | −150–190 °C, −238–374 °F, 123–463 K |
| Моноклінна[6] | P21/c | 14 | mP48 | 0,733 | 1,449 | 0,747 | 8 | 190–400 °C, 374–752 °F, 463–673 K |
Виробництво
Дигідрофосфат калію утворюється в результаті реакції ортофосфатної кислоти з карбонатом калію.
Застосування
Порошок дигідрофосфату калію як добриво містить еквівалент 52 % P2O5 і 34 % K2O і має маркування NPK 0-52-34. Порошок дигідрофосфату калію часто використовується як джерело поживних речовин у теплиці та в гідропоніці.
Як кристал, дигідрофосфат калію відомий своїми нелінійними оптичними властивостями. Використовується в оптичних модуляторах і для нелінійної оптики, наприклад, генерації другої гармоніки (подвоєння частоти).
дидейтерійфосфат калію KD*P має дещо інші властивості. Високодейтерований дигідрофосфат калію використовується в нелінійному перетворенні частоти лазерного світла замість протонованого (звичайного) дигідрофосфату калію через те, що заміна протонів дейтронами в кристалі зміщує третій обертон сильної молекулярної розтяжки OH до більших довжин хвиль, переміщаючи його переважно за межі діапазону основної лінії при приблизно на 1064 нм неодимових ларезів. Звичайний дигідрофосфат калію має поглинання на цій довжині хвилі приблизно 4,7–6,3 % на см товщини, тоді як високодейтерований дигідрофосфат калію має поглинання, як правило, менше 0,8 % на см.
Дигідрофосфат калію використовується як інгредієнт у спортивних напоях, таких як Gatorade і Powerade.
У медицині дигідрофосфат калію використовується для заміщення фосфатів при гіпофосфатемії.[7]
Галерея
 Великий кристал дигідрофосфату калію, який використовується у формі зрізів у Національному комплексі лазерних термоядерних реакцій
Великий кристал дигідрофосфату калію, який використовується у формі зрізів у Національному комплексі лазерних термоядерних реакцій Альтернативний кут, під накриттєм
Альтернативний кут, під накриттєм
Примітки
- Крістофер К. Метьюз, К. Е. Ван Голде, Дін Р. Епплінг та Дж. Спенсер. Anthony-Cahill. Biochemistry. Redwood City, CA: Benjamin/Cummings Pub., 1990. Print. (англ.)
- Ясухіро Оно; Томоюкі Хікіта; Такуро Ікеда (1987). Phase Transitions in Mixed Crystal System K1−x(NH4)xH2PO4. Journal of the Physical Society of Japan 56 (2): 577. Bibcode:1987JPSJ...56..577O. doi:10.1143/JPSJ.56.577. (англ.)
- Potassium Dihydrogen Phosphate. American Elements. Процитовано 30 жовтня 2018. (англ.)
- Клаус Шредтер; Герхард Беттерманн; Томас Стаффель; Фрідріх Валь; Томас Кляйн; Томас Гофман (2012). «Phosphoric Acid and Phosphates». Енциклопедія промислової хімії Уллмана. Вайнгайм: Wiley-VCH. doi: 10.1002/14356007.a19_465.pub3. (англ.)
- Т. Фукамі (1990). Refinement of the Crystal Structure of KH2PO4 in the Ferroelectric Phase. Physica Status Solidi A 117 (2): K93–K96. Bibcode:1990PSSAR.117...93F. doi:10.1002/pssa.2211170234. (англ.)
- Кадзуюкі Іто; Тецуо Мацубаясі; Ейдзі Накамура; Хіроші Мотегі (1975). X-Ray Study of High-Temperature Phase Transitions in KH2PO4. Journal of the Physical Society of Japan 39 (3): 843. Bibcode:1975JPSJ...39..843I. doi:10.1143/JPSJ.39.843. (англ.)
- Андре Гаасбек; А. Едо Мейндерс (Жовтень 2005). Hypophosphatemia: an update on its etiology and treatment. The American Journal of Medicine 118 (10): 1094–1101. ISSN 0002-9343. PMID 16194637. doi:10.1016/j.amjmed.2005.02.014. (англ.)
Посилання
- International Chemical Safety Card 1608
- EPA: Potassium dihydrogen phosphate Fact Sheet
- Potassium Phosphate – a Hydroculture Salt