Буферний розчин
Буферний розчин (рос. буферный раствор, англ. buffer solution, нім. Pufferlösung f) — водний розчин, що містить сполуки, які протистоять значній зміні pH при додаванні невеликої кількості кислоти або основи[1][2][3][4].

Загальний опис
Буферними системами називають розчини, які здатні зберігати постійну концентрацію йонів Гідрогену, тобто значення рН середовища, при додаванні до них невеликих кількостей кислоти чи лугу або при розбавлянні їх.
Інколи поняття «буферний розчин» використовують у ширшому розумінні: для розчинів, що мають будь-який сталий параметр (окисно-відновний потенціал, активність іонів кальцію тощо), що майже не змінюється при незначній зміні складу системи, наприклад під час концентрування, розбавлення, додаванні невеликих кількостей сторонніх сполук. Стабільність досягається завдяки тому, що компоненти буферної системи перебувають у стані хімічної рівноваги[5].
Буфери широко використовуються у хімічних, біологічних та медичних лабораторіях для підтримання сталого pH середовища, в якому відбуваються хімічні реакції. Вони також входять до складу великої кількості промислових товарів, таких як деякі медичні препарати (наприклад забуферений аспірин), засоби для догляду за шкірою і волоссям тощо. Буферні розчини необхідні для забезпечення гомеостазу живих організмів, наприклад pH крові людини підтримується на сталому рівні, оптимальному для транспорту кисню (близько 7,4), завдяки кільком буферним системам[2].
Для забезпечення сталого рівня pH буфер повинен містити дві сполуки: одну, яка б перешкоджала зменшенню концентрації іонів (H3O)+ (або спрощено — H+), іншу — яка б перешкоджала її збільшенню, при цьому вони не повинні нейтралізувати одна одну.
До буферних систем належать суміші, що містять:
- слабку кислоту (донора протонів) і сіль цієї кислоти, утворену сильною основою, (акцептор протонів) наприклад ацетатний буфер (CH3COOH + CH3COONa), гідрогенкарбонатний буфер (H2CO3 + NaHCO3);
- слабку основу і сіль цієї основи, утворену сильною кислотою, наприклад амонійній буфер (NH4OH + NH4Cl);
- солі багатоосновних кислот, наприклад фосфатний буфер (Na2HPO4 + NaH2PO4), карбонатний буфер (Na2CO3 + NaHCO3);
- сильну або слабку кислоту (кислотний компонент) і гліцин або луг (основний компонент).
Механізм дії буферних систем
Нехай буферна система містить приблизно рівні концентрації слабкої кислоти (AH) та спряженої з нею основи (A-), при додаванні до неї сильної кислоти, що є донором іонів H+, останні зв'язуватимуться із основою A-:
- H3O+ + A- → H2O + AH.
З іншої сторони, при додаванні невеликої кількості лугу, що постачає іони OH- у розчин, з ними взаємодіятиме слабка кислота:
- OH- + AH → H2O + A-.
Ці дві оборотні реакції і забезпечують буферні властивості розчину: додавання до розчину іонів H+ чи OH- має наслідком зміну співвідношення слабкої кислоти і спряженої основі, і зовсім незначний зсув pH[3][6].
Досить поширеною є хибна думка про те, що буферні розчини здатні підтримувати pH на абсолютно сталому рівні. Насправді це не так, додавання навіть невеликої кількості кислоти чи лугу до такого розчину призводить до зміни водневого показника, проте дуже незначної[7]. Наприклад, якщо додати до 1 л чистої води 0,01 моль хлоридної кислоти, то її pH зміниться від 7,0 до 2,0, тобто на 5 одиниць, з іншого боку, при додаванні такої ж кількості кислоти до 1 л буферного розчину, його pH може змінитись всього на 0,1[3].
Буферна ємність і область буферування
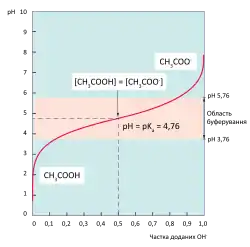
Здатність будь-якого буферного розчину підтримувати приблизно сталий рівень pH є обмеженою. При додаванні достатньої кількості кислоти чи основи до буферу, його pH врешті почне стрімко падати чи зростати відповідно. Кількість іонів H3O+ або OH-, яку слід додати до буферного розчину, щоб змінити його водневий показник на одиницю називається буферною ємністю[8].
Буферна ємність залежить від концентрації компонентів розчину та їх співвідношення. Чим більша концентрація слабкої кислоти і спряженої основи, тим більшою буде буферна ємність розчину. Стандартно використовуються молярні концентрації принаймні у 100 раз вищі за константу кислотної дисоціації (Ka) слабкої кислоти[9], і принаймні у 10 разів вищі за концентрацію іонів H3O+ чи OH-, яку слід нейтралізувати[10].
Найбільш ефективними є буфери, в яких співвідношення компонентів розчину максимально близьке до 1, коли ж воно більше 10:1 або менше 1:10, такі буфери зовсім не придатні до використання. У випадку коли [AH]: [A-]=1:1 pH буферного розчину рівний pKa слабкої кислоти, при цьому буферна ємність розчину буде найбільш симетричною, тобто він може однаково ефективно протистояти закисленню і залужненню. Для кожної пари слабка кислота/спряжена основна існує так звана область буферування, тобто діапазон pH, в якому вона може використовуватись для створення ефективного буферного розчину. Область буферування визначається як pKa слабкої кислоти ±1[8]. Отже для буфера із pH 5 можна використати пару оцтова кислота/ацетат (pKa=4,76), а для буфера із pH 9 — аміак/амоній (pKa=9,25)[6].
pH буферного розчину
pH буферного розчину за відомого співвідношення між кількостями слабкої кислоти та спряженої основи можна визначити, використовуючи рівняння Гендерсона-Гассельбаха:
- ,
де pKa — константа кислотної дисоціації слабкої кислоти, [AH] — її молярна концентрація, [A-] — молярна концентрація спряженої основи. Із наведеного рівняння можна зробити висновок, що, коли концентрація основи перевищує концентрацію кислоти, то pH буферного розчину вищий за pKa, коли ж [AH] > [A-], то навпаки — нижчим[11][12][6][13].
Отже для приготування буфера із бажаним pH можна вибрати слабку кислоту (чи основу) із максимально наближеним значенням pKa і розрахувати за рівнянням Гендерсона-Гассельбаха співвідношення кислоти і спряженої основи, які потрібно змішати. Можливо також використати й інші шляхи: наприклад, титрувати розчин слабкої кислоти сильним лугом, або її солі сильною кислотою до потрібного pH[14].
Зміна pH буферного розчину при додаванні сильних кислот чи основ
Щоб обчислити, як зміниться pH буферного розчину при додаванні відомої кількості сильної кислоти чи основи, слід спершу використати принципи стехіометрії, щоб з'ясувати яка кількість одного компонента буферного розчину при цьому перетвориться в інший. Припускається, що реакція нейтралізації відбувається до кінця (наприклад, якщо до ацетатного буфера додати 0,1 моль гідроксиду натрію, то можна вважати, що кількість оцтової кислоти в розчині зменшиться на 0,1 моль, а кількість ацетату збільшиться на таке ж значення). Отримані значення нових концентрацій компонентів буфера можна підставити у рівняння Гендерсона-Гассельбаха для обчислення рівноважного значення pH[14].
Практичне значення pH буферів
Буферні системи існують всередині всіх живих клітин, оскільки більшість із хімічних перетворень, що відбуваються в них залежні від pH. Із цієї ж причини у лабораторіях під час дослідження властивостей білків, особливо ферментів, нуклеїнових кислот та інших біомолекул завжди використовують pH буфери.
pH буфери широко використовуються у багатьох галузях промисловості і в лабораторній практиці. Наприклад, один із перших етапів пивоваріння — подрібнення солоду - повинен відбуватись при pH від 5,0 до 5,2. Із виготовленням пива пов'язане і саме відкриття шкали pH, оскільки її винахідник Сорен Соренсон працював дослідником на броварні[10].
Буферні системи крові людини
pH крові людини в середньому становить 7,4, зміна цього значення навіть на одну десяту одиниці призводить до важких порушень (ацидозу або алкалозу). Коли водневий показник виходить за межі діапазону 6,8÷7,8, це зазвичай веде до загибелі. Найважливіша буферна система крові — карбонатна (HCO–3/H2CO3), друга за значенням — фосфатна (HPO2–4/H2PO–4), також певну роль у підтриманні pH відіграють білки[15].
pH буфери у біологічних лабораторіях
| Буферний агент | pKa |
| Трис | 8,3 |
| TES | 7,55 |
| HEPES | 7,55 |
| MOPS | 7,2 |
| PIPES | 6,8 |
В експериментах із біохімії та молекулярної біології первинно використовувались звичайні буфери на основі слабких кислот та їхніх спряжених основ, такі як цитратні, ацететні, фосфатні. Проте вони мали ряд недоліків, таких як досить значна зміна pH при розведенні або зміні температури, проникнення їхніх компонентів через клітинні мембрани і вплив на фізіологічні процеси. Тому на зміну їм стали застосовувати буфери на основі інших речовин, наприклад основи трис(гідроксиметил)амінометану (скорочено трис) (наприклад трис-ацетатний, трис-боратний), цвіттер-іонної сполуки MOPS тощо[16].
Норман Гуд розробив серію буферів на основі сполук, молекули яких можуть перебувати у стані цвіттеріонів, таких як HEPES, PIPES, MES. Гуд відбирав буферні агенти на основі таких бажаних ознак як: значення pKa в діапазоні 6÷8, що відповідає фізіологічним значенням pH, висока розчинність у воді, нерозчинність у полярних сполуках, непроникність через мембрани, малий вплив на іонну силу розчину, максимальна незалежність дисоціації від температури і концентрації, стабільність, легкість у приготуванні. Також буферні агенти не повинні поглинати видиме і ультрафіолетове світло із довжиною хвилі більше 230 нм, щоб не перешкоджати стандартним методам спектрофотометрії. Жодна із відомих сполук не підходить ідеально під всі описані ознаки, проте наявний вибір буферних агентів дозволяє вибрати належний для кожного конкретного завдання[17].
Інші типи буферних систем
У хімічному аналізі застосовують також інші буферні системи: окисно-відновні буферні розчини для утворення і збереження окисно-відновного потенціалу, наприклад на основі суміші солей Fe(II) і Fe(III); кальцієвий буферний розчин для утворення і збереження активності катіонів кальцію, наприклад на основі суміші еквімолярної кількості дигліколяту натрію та кальцію або натрієвої і кальцієвої солей нітрилацетатної кислоти. В іонометрії широко використовуються буферні розчини для утворення загальної іонної сили розчину (БРЗІС)[5].
Буферний розчин сталої йонної сили
Буферний розчин з високою йонною силою, що додається до аналiзованого й каліброваного розчинiв з метою забезпечення в них однакової йонної сили при рiвнiй активностi йонiв Н+ в цих розчинах.
Див. також
Примітки
- Nelson et al, 2008, с. 59.
- Stoker, 2010, с. 274.
- Ebbing et al, 2009, с. 675.
- Bettelheim et al, 2012, с. 261.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Nelson et al, 2008, с. 60.
- Stoker, 2010, с. 276.
- Ebbing et al, 2009, с. 676.
- Pertucci et al, 2011, с. 754.
- Pertucci et al, 2011, с. 759.
- Stoker, 2010, с. 277.
- Ebbing et al, 2009, с. 681—682.
- Bettelheim et al, 2012, с. 265—266.
- Pertucci et al, 2011, с. 756.
- та Bettelheim et al, 2012, с. 264—265.
- Bettelheim et al, 2012, с. 266—268.
- Will MA, Clark NA, Swain JE (2011). Biological pH buffers in IVF: help or hindrance to success. J Assist Reprod Genet. 28: 711—24. PMID 21614519. doi:10.1007/s10815-011-9582-0.
Джерела
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Petrucci R.H., Herring G.F., Madura J.D., Bissonnette C. (2011). General Chemistry: Principles and Modern Applications (вид. 10th). Toronto: Pearson Canada. ISBN 978-0-13-206452-1.
- Bettelheim F.A., Brown W.H., Campbell M.K., Farrell S.O., Torres O.J. (2012). Introduction to General, Organic, and Biochemistry (вид. 10th). Brooks/Cole, Cengage Learning. ISBN 978-1-133-10508-4.
- Ebbing D.D., Gammon S.D. (2009). General Chemistry (вид. 9th). Houghton Mifflin Company. ISBN 978-0-618-93469-0.
- Stoker S.H. (2010). General, Organic, and Biological Chemistry (вид. 5th). Brooks/Cole, Cengage Learning. ISBN 978-0-547-15281-3.