Ексцизійна репарація основ
Ексцизі́йна репара́ція осно́в (англ. base excision repair (BER)) — система репарації ДНК, що видаляє з подвійної спіралі пошкоджені азотисті основи. BER починається з розпізнавання і видалення пошкодженої основи ДНК-глікозилазами. Далі особлива ендонуклеаза видаляє уривок ланцюга, що містить нуклеотид без основи, і ДНК-полімерази забудовують пролом. Розрізняють BER з точковою латкою, при якій видаляється тільки нуклеотид, позбавлений азотистої основи, або BER з короткою латкою, при якій видаляється короткий уривок, що містить пошкоджений нуклеотид[1].
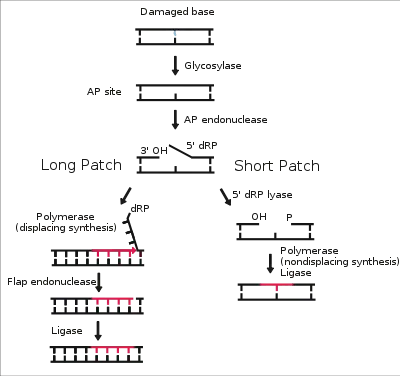
Механізм
BER починається з розпізнавання ДНК-глікозилазами пошкоджених основ (наприклад, алкілованих), неспарених основ, а також урацилу, який в нормі відсутній в ДНК і є тільки в РНК. Глікозилаза розрізає зв'язок азотистої основи з дезоксирибозою, видаляючи її з ДНК. Деякі глікозилази також є ліазами і вносять розрив у ланцюг ДНК з 3'-кінця пошкодженого нуклеотиду, використовуючи аміногрупу як нападну групу. Подальший хід репарації визначається тим, чи брала участь ліаза у видаленні пошкодження[2].
Якщо глікозилаза виступала як ліаза, то BER іде по шляху з точковою латкою. AP-ендонуклеаза APE1 вносить розрив у 5'-кінця пошкодженого нуклеотиду і він покидає ДНК. Новоутворений пролом забудовується ДНК-полімеразою β і лігується ДНК-лігазою XRCC1/Lig3[3].
Якщо ліазної активності не було, то з утвореним AP-сайтом (тобто апуриновим і апіримідиновим) зв'язується ендонуклеаза APE1, яка видаляє пошкоджений нуклеотид і від двох до десяти його сусідів. Далі реплікативне поєднання, що складається з ДНК-полімераз δ і ε та інших складників, забудовує пролом, витісняючи прилеглі нормальні нуклеотиди. Витиснені при цьому нормальні нуклеотиди видаляються ендонуклеазою FEN1. Далі новосинтезована ділянка лігується лігазою 1[3].
Механізм розпізнавання пошкоджених основ зазвичай заснований на тому, що вони порушують структуру подвійної спіралі ДНК і «вискакують» зі спіралі, потрапляючи безпосередньо в активне осереддя глікозилази[4].
Пошкоджені основи не завжди підлягають видаленню. Наприклад, при репарації метильованих аденінових нуклеотидів метильна група окислюється особливими ферментами до CH2OH, далі вивільняється формальдегід (HCHO) і вихідна структура аденіну відновлюється[5].
Вибір шляху BER — з точковою або з короткою латкою — може також залежати від стадії клітинного циклу і ступеня диференціювання клітини[6]. Крім того, два механізми використовуються різними організмами з різною частотою. Наприклад, у дріжджів Saccharomyces cerevisiae, мабуть, відсутня репарація точкової латкою, адже у них не виявлено гомологів людських генів, білкові продукти яких беруть участь в цьому шляху[7].
Клінічне значення
Дефекти в різних шляхах репарації ДНК сприяють розвитку раку, і BER не є винятком. У найрізноманітніших організмах порушення в генах, білкові продукти яких задіяно в BER, призводять до різкого підвищення частоти мутацій, що є передумовою для ракових захворювань. Дійсно, соматичні мутації, що зачіпають ДНК-полімерази β, спостерігаються в 30% випадків раку, і деякі з них викликають злоякісну трансформацію у мишей[8]. Діяльність репарації пошкоджених основ і нуклеотидів в клітинах голого землекопа набагато вища, ніж в клітинах миші, і може бути відповідальною за те, що середня тривалість життя цього гризуна 30 років, тоді як у звичайної миші — півтора року[9]. Мутації ДНК-глікозилази MUTYH підвищують ризик розвитку раку товстої кишки[10].
Примітки
- Кребс, Голдштейн, Килпатрик, 2017, с. 397.
- Кребс, Голдштейн, Килпатрик, 2017, с. 397—398.
- Кребс, Голдштейн, Килпатрик, 2017, с. 398.
- Кребс, Голдштейн, Килпатрик, 2017, с. 398—399.
- Кребс, Голдштейн, Килпатрик, 2017, с. 399.
- PMID 17129767 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 17983848 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - PMID 15280658 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота. - (рос.) Исследователи ИХБФМ СО РАН и ИМКБ СО РАН установили возможную причину долгожительства голого землекопа, 9 ноября 2018 г.
- PMID 15931596 (PubMed)
Бібліографічний опис з'явиться автоматично через деякий час. Ви можете підставити цитату власноруч або використовуючи бота.
Література
- (рос.) Кребс Дж., Голдштейн Э., Килпатрик С. Гены по Льюину. — М. : Лаборатория знаний, 2017. — 919 с. — ISBN 978-5-906828-24-8.
Шаблон:Репарація ДНК