Згортання білків
Згортання білків (інколи фолдинг, від англ. Protein folding) — фізичний процес, у якому поліпептидна молекула згортається в характерну для даного білка тривимірну структуру[1]. Кожний білок синтезується як лінійний поліпептид в процесі трансляції послідовності мРНК в лінійну послідовність амінокислот. Цей поліпептид не має ніякої тривимірної структури. Однак кожна амінокислота в ланцюгу має певні характерні для неї хімічні властивості, такі як, наприклад, гідрофобність та електричний заряд. Завдяки цим властивостям амінокислоти взаємодіють одна з одною певним чином, утворюючи чітко визначену для даного поліпептиду тривимірну форму, згорнутий білок або білок у нативному стані. Кінцева тривимірна структура повністю визначається (окрім спеціальних випадків) його амінокислотною послідовністю[2].
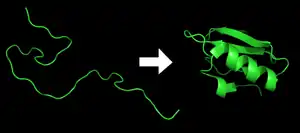
Для стабілізації третинної структури багато білків в клітині піддаються посттрансляційній модифікації. Вельми часто зустрічаються дисульфідні містки між просторово близькими ділянками поліпептидного ланцюга.
Для багатьох білків правильна тривимірна структура необхідна для функціонування[3]. Неправильна структура приpводить до утворення неактивних білків, які часто блокують роботу своїх потенційних партнерів, порушуючи роботу всієї клітини. В окремих випадках неправильна структура може навіть передаватися іншим білкам, як це трапляється з пріонами. Кілька нейродегенеративних хвороб, як вважається, виникають через накопичення неправильно згорнутих білків[4]. Накопичення неправильно згорнутих білків у цитозолі призводить до запуску сигнального шляху, що називається відповідь на тепловий шок. Він призводить до збільшення експресії білків-шаперонів, які допомагають надати незгорнутим поліпептидам правильної конформації. У випадку стресу ендоплазматичного ретикулуму, тобто коли спостерігається висока концентрація неправильно згорнутих білків у цій органелі, в клітині запускається так звана відповідь на незгорнуті білки (англ. unfolded protein response). Її завданням є збільшення кількості шаперонів ендоплазматичного ретикулуму, білків, що беруть участь у ретротранслокації поліпептидів у цитозоль, де вони підлягають деградації, та інших білків, що сприяють збільшенню здатності ендоплазматичного ретикулуму здійснювати фолдинг[5].
Обчислення
Експериментальне визначення тривимірної структури білків часто є дуже складним та затратним, проте дані про послідовність білка часто вже існують. У результаті дослідники намагаються використовувати обчислювальні методи для симуляції процесу згортання білка і передбачити таким чином структуру його нативного стану. Цей напрямок досліджень зараз став одним з найважливіших в обчислювальній хімії та біології.
В листопаді 2020 року група дослідників проєкту DeepMind повідомила, що їм вдалось досягти значних успіхів у розв'язанні цієї задачі методами штучного інтелекту та глибинного навчання[6].
Див. також
Посилання
- Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters (2002). The Shape and Structure of Proteins. Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1.
- Anfinsen C (1972). The formation and stabilization of protein structure. Biochem. J. 128 (4): 737–49. PMID 4565129.
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer; Web content by Neil D. Clarke (2002). 3. Protein Structure and Function. Biochemistry. San Francisco: W.H. Freeman. ISBN 0-7167-4684-0.
- Science of Folding@Home. 18 липня 2005. Архів оригіналу за 26 червня 2013. Процитовано 22 квітня 2007.
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. с. 740. ISBN 978-0-8153-4105-5.
- John Timmer (1 грудня 2020). DeepMind AI handles protein folding, which humbled previous software. Ars Technica.