Структура білків
Білки — важливий клас біологічних макромолекул, що містяться у всіх біологічних організмах, та складаються переважно з вуглецю, водню, азоту, фосфору, кисню і сірки. Всі білки є полімерами амінокислот. Ці полімери також відомі як поліпептиди і складаються з послідовності 20 різних L-α-амінокислот, що також називаються амінокислотними залишками. Для ланцюжків довжиною приблизно до 40 залишків замість терміну «білок» частіше використовується термін «пептид». Щоб бути здатним виконувати свою біологічну функцію, кожен білок приймає одну або більше конформацій, що утворюються за допомогою ряду нековалентних взаємодій, таких як водневі зв'язки, іонні, вандерваальсівські і гідрофобні взаємодії. Для того, щоб зрозуміти функцію білків на молекулярному рівні, часто необхідно визначити тривимірну структуру білків. Галузь біології, що займається встановленням структури білків, називається структурною біологією та використовує такі методи як рентгеноструктурний аналіз і ЯМР-спектроскопія.
Число залишків, необхідне для виконання більшості специфічних біохімічних функцій, становить близько 40—50, що, здається, є нижчою межею розміру переважної більшості доменів. Розміри білків (але не пептидів) змінюються від цієї нижчої межі до кількох тисяч залишків в багатофункціональних або структурних білках. Оцінка середньої довжини більшості білків становить близько 300 залишків. Білки також часто формують білкові комплекси, що складаються з білкових субодиниць, наприклад багато тисяч молекул актину збираються у довгі мікрофіламенти.
Вступ
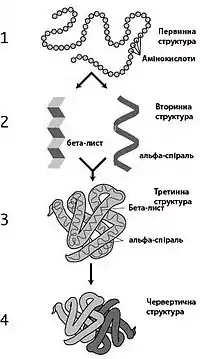
Для функціонування білків украй важлива як Їх амінокислотна (пептидна) послідовність, так і тривимірна структура, яка формується в процесі згортання (англ. folding). Тривимірна структура білків за нормальними природними умовами називається нативним станом білка. Зазвичай структура білків поділяється на чотири рівні:
- Первинна структура — послідовність амінокислот у пептидному ланцюжку.
- Вторинна структура — регулярні підструктури (наприклад альфа-спіралі і бета-листи), які визначаються локально, таким чином що в одній молекулі білка зазвичай існує багато подібних структурних елементів (мотивів).
- Третинна структура — тривимірна структура єдиної білкової молекули, просторове розташування вторинних структур.
- Четвертинна структура — комплекс кількох молекул білка або поліпептидних ланцюжків, який зазвичай називають білком у цьому контексті, що функціонують разом у складі білкового комплексу.
На додаток до цих рівнів структури, білок може змінюватися між кількома подібними структурами в процесі виконання своєї біологічної функції. У контексті цих функціональних перестановок, ці третинні або четвертні структури зазвичай називаються конформаціями, а переходи між ними — конформаційними змінами.
Первинна структура утримується за допомогою пептидних зв'язків типу ковалентних зв'язків, що утворюються в процесі стадії трансляції біосинтезу білків. Ці пептидні зв'язки забезпечують жорсткість білка. Два кінці амінокислотного ланцюжка називаються C-кінцем або карбоксильним кінцем і N-кінцем або аміно-кінцем, заснувуючись природі вільної групи на кожному кінці.
Різні види вторинної структури виникають локально між амінокислотами поліпептидного ланцюжка і стабілізуються водневими зв'язками. Проте, ці водневі зв'язки загалом недостатньо стійкі самостійно, тому що водневий зв'язок з молекулами води зазвичай сприятливіший, ніж водневий зв'язок між амідними групами. Тому вторинна структура стійка тільки коли локальна концентрація води достатньо низька, наприклад, в межах глобули або у повністю згорнутому білку.
Так само як і вторинна структура, утворення глобул і третинної структури стабілізується переважно структурно неспецифічними взаємодіями, наприклад спорідненістю амінокислот і гідрофобними взаємодіями. Проте, третинна структура стабілізується тільки коли деякі частини білка закріплені структурно специфічними взаємодіями, наприклад іонними зв'язками (солевими містками), водневими зв'язками і стерічною упаковкою бічних ланцюжків. Третинна структура позаклітинних білків може також стабілізуватися дисульфідними зв'язками, які скорочують ентропію розгорненого стану. Дисульфідні зв'язки надзвичайно рідкі в цитоплазмених білках, тому що цитозоль зазвичай є відновлюючим оточенням.
Структура амінокислот
Пептидний зв'язок
Рівні структури білків
Первинна структура
- Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків в пептидному ланцюжку. В основі утворення первинної структури лежать пептидні зв'язки. До складу білка входять як кислі, так і лужні амінокислоти, тому будь-який білок має амфотерні властивості. Саме первинна структура кодується відповідним геном і у найбільшій мірі визначає властивості готового білка.
Вторинна структура
- Вторинна структура характеризує просторову форму білкової молекули, яка найчастіше повністю або частково закручується у спіраль. Амінокислотні радикали (R-групи) залишаються при цьому ззовні спіралі. У стабілізації вторинної структури важливу роль відіграють водневі зв'язки, які виникають між атомами водню NH-групи одного завитка спіралі та кисню CO-групи іншого й спрямовані вздовж спіралі. Хоча ці зв'язки значно слабші за пептидні, однак разом вони формують досить міцну структуру.
Елементи вторинної структури
Найпоширеніші типи вторинної структури білків включають α-спіралі та β-листи[1]:
- α-спіралі — щільні витки навколо довгої осі структури, один виток становлять 4 амінокислотних залишки, спіраль стабілізована водневими зв'язками між атомами H і O пептидних груп, віддалених одна від одної на 4 ланки. Спіраль може бути як лівозакрученою, так і правозакрученою, хоча зазвичай переважає правозакручена. Спіраль порушують електростатичні взаємодії глутамінової кислоти, лізину, аргініну, розташовані поруч аспарагін, серин, треонін і лейцин можуть стерично заважати утворенню спіралі, пролін викликає вигин ланцюга і також порушує спіраль.
- β-листи (складчасті шари) — декілька зигзагоподібних поліпептідних ланцюжків, в яких водневі зв'язки утворюються між відносно віддаленими ділянками ланцюжка або між різними ланцюжками, а не між близько розташованими амінокислотами, як це має місце в α-спіралі. Ці ланцюжки зазвичай направлені N-кінцями в різні боки (антипаралельна орієнтація). Для утворення листів важливі невеликі розміри R-груп амінокислот, у цих структурах зазвичай переважають гліцин і аланін.
- π-спіралі;
- -спіралі;
- невпорядковані фрагменти.
Номенклатура DSSP
Для опису вторинної структури часто використовується номенклатура DSSP, що описує окремі елементи цієї структури за допомогою однобуквеного коду. DSSP — акронім «Словника вторинної структури білків» (англ. Dictionary of Protein Secondary Structure), який був заголовком статті, що ввела ці позначення, і фактично є списком елементів вторинної структури білків з відомою тривимірною структурою (Kabsch і Sander 1983).
- G = 3-амінокислотна спіраль (310-спіраль). Мінімальна довжина 3 амінокислоти.
- H = 4-амінокислотна спіраль (альфа-спіраль). Мінімальна довжина 4 амінокислоти.
- I = 5-амінокислотна спіраль (пі-спіраль). Мінімальна довжина 5 амінокислот.
- T = поворот, стабілізований водневими зв'язками (3, 4 або 5 амінокислот)
- E = бета-лист в паралельній або антипаралельній конфігурації. Мінімальна довжина 2 амінокислоти.
- B = амінокислота в ізольованому бета-містку (формація з одної пари водневих зв'язків бета-листа)
- S = поворот (єдина нестабілізована водневими зв'язками структура в списку)
У DSSP амінокислотні залишки, які входять до одної з наведених структур, позначаються як " " (пробіл), або іноді позначається як C (кільце) або L (петля). Спіралі (G, H і я) і листові структури — всі повинні мати розумну довжину. Це означає, що два сусідні залишки в первинній структурі повинні сформувати той же тип водневого зв'язку. Якщо спіралі або стабілізований водневими зв'язками лист дуже короткі, вони позначаються як T або B відповідно. Існують й інші категорії елементів вторинної структури (круті повороти, омега-петлі тощо), але вони використовуються відносно рідко.
Третинна структура
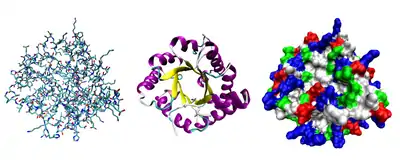
Третинна структура — повна просторова будова єдиної білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура загалом стабілізується нелокальними взаємодіями, звичайніше всього формуванням гідрофобного ядра, але також через утворення водневих зв'язків, сольових містків, інших типів іонних взаємодій, дисульфідних зв'язків між залишками цистеїну.
«Надвторинна» структура
Більшість білків організовані на кількох проміжних рівнях між основними елементами вторинної структури та повною структурою поліпептидного ланцюжка. Цю організацію часто називають «надвторинною» структурою, а її елементи — структурними мотивами та доменами.
Структурний мотив визначається як елемент структури, що зустрічається в різних білках і пов'язаний з виконанням подібної дії. Зазвичай (але не завжди) це означає невелику специфічну комбінацію елементів вторинної структури, наприклад спіраль-поворот-спіраль має три таких елементи. Хоча просторова послідовність елементів однакова у всіх зразках мотиву, вони можуть кодуються в будь-якому порядку в межах нуклеотидної послідовності гену. Структурні мотиви часто включають петлі змінної довжини і невизначеної структури, які і створюють необхідні з'єднання, сполучаючи в просторі елементи, що не кодуються безпосередньо один за одним. Навіть коли два гени кодують елементи вторинної структури мотиву в тому ж порядку, вони можуть мати різні амінокислотні послідовності. Це вірно не тільки через складний зв'язок між первинною та вторинною та третинною структурами, але й через різні розміри мотивів в складі різних білків. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка. Хоча структурні мотиви можуть бути аналогічними, частіше за все вони зберігаються в процесі еволюції видів.
Домен — дещо більший елемент структури білка, що самостійно стабілізується і зазвичай згортається незалежно від решти частин поліпептидного ланцюжка, і що часто виконують окрему функцію. Багато доменів не унікальні до одного типу білків або навіть білкового сімейства, але зустрічаються в різноманітності білків. Домени часто називаються і визначаються згідно з функцією, яку вони виконують, та назвою білка, де вони знайдені, наприклад, «кальцій-зв'язуючий домен кальмодуліну». Через їхнє незалежне згортання та стабілізацію, домени можна субклонувати («пересаджувати») з одного білка на інший за допомогою генної інженерії, створюючи химерні білки з новими функціями.
Незважаючи на факт, що існує близько 100 тис. різних білків у клітинах еукаріотів, існує набагато менше різних структурних мотивів та доменів. Це є наслідком еволюції, тому що гени часто виникають за рахунок дуплікації або переміщення частини генетичного матеріалу в межах геному. Таким чином, домен може бути переданий від одного білка до іншого, надаючи цьому білку нову функцію. Через подібні процеси, кожний домен прагне використовуватися багато разів у кількох різних білках.
Четвертинна структура
Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, названих в даному контексті субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом.
Згортання білків
Примітки
- Branden C, Tooze J. (1999). Introduction to Protein Structure 2nd ed. Garland Publishing: New York, NY