Мурашина кислота
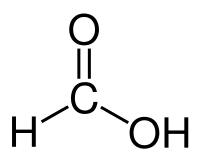
Мураши́на кислота́ (систематична назва метанова кислота, англ. Formic acid), H-COOH — безбарвна рідина з різким запахом, кипить при 101 ˚С. Розчиняється у воді в будь-яких пропорціях. Викликає опіки на шкірі. Міститься у виділеннях залоз мурашок, а також у деяких рослинах (у листі кропиви).
| Мурашина кислота | |
|---|---|
 | |
 | |
| Систематична назва | Метанова кислота |
| Ідентифікатори | |
| Номер CAS | 64-18-6 |
| Номер EINECS | 200-579-1 |
| DrugBank | 01942 |
| KEGG | C00058 |
| ChEBI | 30751 |
| RTECS | LQ4900000 |
| SMILES |
C(=O)O[1] |
| InChI |
InChI=1S/CH2O2/c2-1-3/h1H,(H,2,3) |
| Номер Бельштейна | 1209246 |
| Номер Гмеліна | 1008 |
| Властивості | |
| Молекулярна формула | HCO2H |
| Зовнішній вигляд | безбарвна прозора рідина |
| Густина | 1,22 г/л |
| Тпл | 8,4 °C |
| Ткип | 100,8 °C |
| Кислотність (pKa) | 3,77 [2] |
| Ідентифікатори | |
| Номер CAS | 64-18-6 |
| PubChem | 284 |
| Номер EINECS | 200-579-1 |
| DrugBank | DB01942 |
| KEGG | C00058 |
| ChEBI | 30751 |
| RTECS | LQ4900000 |
| SMILES |
C(=O)O |
| InChI |
1/CH2O2/c2-1-3/h1H, (H,2,3) |
| Номер Бельштейна | 1209246 |
| Номер Гмеліна | 1008 |
| Структура | |
| Геометрія | Planar |
| Дипольний момент | 1,41 D(gas) |
| Небезпеки | |
| MSDS | JT Baker |
| R-фрази | R10 R35 |
| S-фрази | (S1/2) S23 S26 S45 |
| Головні небезпеки | sensitizer. |
| NFPA 704 |
 2
3
1
|
| Температура спалаху | 69 °C (156 °F) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Мурашину кислоту широко використовують у хімічній промисловості як відновник при синтезі органічних речовин, а також для добування щавлевої (оксалатної кислоти) в харчовій промисловості — як консервуючий і дезинфікуючий засіб, у медицині — як засіб розтирання при ревматизмі. Також використовують в органічному синтезі, текстильній промисловості, виробництві фарб, гуми.
Мурашина кислота — єдина із карбонових кислот, у молекулі якої міститься альдегідна група -СОН. Тому вона, як і альдегіди, окиснюється перманганатом калію, оксидом аргентуму(I) у розчині аміаку (тобто дає реакцію «срібного дзеркала»). При нагріванні з концентрованою сульфатною кислотою мурашина кислота розкладається на оксид карбону(ІІ) і воду.
Способи отримання
Карбонові кислоти добувають у промисловості переважно за допомогою реакцій окиснення. Основний і перспективний метод ґрунтується на окисненні алканів. Карбонові кислоти також добувають окисненням альдегідів і спиртів. Продуктом реакції за участю альдегідів є кислота. Один із промислових методів добування метанової кислоти полягає у здійсненні реакції оксиду карбону(ІІ) з натронним вапном (сумішшю гідроксидів Натрію і Кальцію) і подальшій взаємодії форміату натрію із сульфатною кислотою:
Це основний промисловий метод, що здійснюється в дві стадії: на першій стадії монооксид вуглецю під тиском 0,6—0,8 МПа пропускають через нагрітий до 120–130 °C гідроксид натрію; на другій стадії проводять обробку форміату натрію сірчаною кислотою й вакуумну перегонку продукту.
У лабораторії карбонові кислоти добувають переважно за реакціями їхніх солей із сильними неорганічними кислотами (зазвичай сульфатною):
Див. також
- Мурашіння
- Форміат натрію
- Пермурашина кислота
Примітки
- formic acid
- Brown, H. C. et al., in Braude, E. A. and Nachod, F. C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.