Пентан-3-он
Пентан-3-он (діетилкетон) — кетон з хімічною формулою .
| Пентан-3-он | |
|---|---|
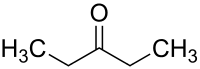 | |
| Назва за IUPAC | Пентан-3-он |
| Систематична назва | Пентан-3-он |
| Інші назви | діетилкетон, диметилацетон |
| Ідентифікатори | |
| Номер CAS | 96-22-0 |
| Номер EINECS | 202-490-3 |
| Номер EC | 606-006-00-5 |
| ChEBI | 87755 |
| RTECS | SA8050000 |
| SMILES |
CCC(=O)CC[1] |
| InChI |
InChI=1S/C5H10O/c1-3-5(6)4-2/h3-4H2,1-2H3 |
| Номер Бельштейна | 635749 |
| Властивості | |
| Молекулярна формула | C5H10O |
| Молярна маса | 86.134 г/моль |
| Молекулярна маса | 86.1 а. о. м. |
| Зовнішній вигляд | Безбарвна рідина |
| Тпл | -42 °C |
| Ткип | 102 °C |
| Розчинність (вода) | 5.2г/100г |
| Розчинність (Тетрахлорметан) | Погано розчинний |
| Тиск насиченої пари | 2.0 кПа (20 °C) |
| Термохімія | |
| Ст. ентропія S |
266 Дж/(моль•К) |
| Небезпеки | |
| Класифікація ЄС | Горючий (F) |
| R-фрази | R11 |
| S-фрази | S2, S9, S16, S33 |
| NFPA 704 |
 3
1
0
|
| Температура спалаху | 13 °C |
| Температура самозаймання | 452 °C |
| Вибухові границі | 1,6–3 % |
| Пов'язані речовини | |
| Пов'язані речовини | Ацетон, Метилетилкетон |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
За звичайних умов пентанон — безбарвна рідина з характерним запахом. Температура плавління -42°С, температура кипіння — 102°С. Легко розчинний в етанолі та діетиловому ефірі, погано розчиняється в тетрахлорметані. Показник заломлення дорівнює 1.3905 при 25°С та 1.3924 при 20°С.
Хімічні властивості
Пентанон — кетон, проявляє слабкі основні властивості через неподілену пару електронів на атомі оксигену. Він приєднує протон, утворюючи оксонієвий катіон. До нього притягується кислотний залишок, утворюючи сіль:
Може реагувати з бромом, але ця реакція відбувається повільно. Спочатку кетон переходить в енольну форму:
Саме ця стадія є причиною малої швидкості реакції, оскільки кетони набагато стійкіші енолів. На наступному етапі молекула брому поляризується, і до молекули на місці подвійного зв'язку приєднується Br+: Тоді протон відривається від молекули, приєднуючись до негативного іону брому з утворенням бромоводню та 2-бромпентан-3-ону:
Взаємодіє з негативними іонами нуклеофілів, утворюючи негативний заряд на атомі оксигену. Якщо до нуклеофілу приєднаний протон, він приєднується до негативного атома оксигену, утворюючи спирт:
Примітки
- 3-PENTANONE
Література
О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.
