Поліацетилен
Поліацетиле́н — полімер з формулою (C2H2)n. Поліацетилен найпростіший за хімічною будовою із електропровідних полімерів. Він є органічним напівпровідником, провідність якого в основному зумовлена домішками. Відкриття провідності поліацетилену на початку 1960 років пробудило інтерес до органічної електроніки.
| Поліацетилен | |
|---|---|
trans-Polyacetylen | |
cis-Polyacetylen | |
| Назва за IUPAC | Polyethyne |
| Інші назви | Polyacetylene, PAc |
| Ідентифікатори | |
| Номер CAS | 25067-58-7 |
| Назва MeSH | D02.455.326.271.665.515, D05.750.223, D25.720.719 і J01.637.051.720.719 |
| ChEBI | 60552 |
| SMILES | |
| InChI | |
| Номер Бельштейна | 9186008 |
| Властивості | |
| Молекулярна формула | [C2H2]n |
| Розчинність (вода) | нерозчинний |
| Небезпеки | |
| R-фрази | R10 |
| S-фрази | - |
| Пов'язані речовини | |
| Пов'язані речовини | Етин (мономер) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Будова
Поліацетилен складається з довгого ланцюжка атомів Карбону, в якому чергуються одинарні й подвійні зв'язки. Крім того кожен атом Карбону зв'язаний з одним атомом Гідрогену. Схематично структура поліацетилену показана на рисунках.
n.svg.png.webp)
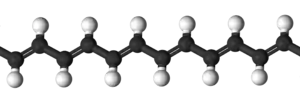
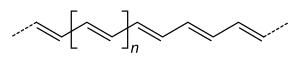

Існують транс- і цис-конфігурації поліацетилену, які відрізняються тим, що в цис-конфігурації обидва атоми Гідрогену розташовані по одну сторону від подвійного зв'язку, а в транс-конфігурації по різні сторони від подвійного зв'язку.
Синтез
Ацетилен полімеризується подібно до етилену: полімеризацію можуть розпочинати аніонні, катіонні або радикальні ініціатори. Здебільшого поліацетилен отримують не полімеризацію ацелитену безпосередньо, оскільки від легко займається і неконтрольова олігомеризується. Найчастіше при синтезі використовують методику полімеризаційного метатезису із відкриттям циклу з участю молекул на зразок циклооктатетраєну та його похідних[1][2][3].
Провідність
1964 світ побачила монографія Органічні напівпровідники[4], яка посилалася на ранні роботи щодо викокої провідності оксидованого поліацетилену. В 1950-их також повідомлялося про високопровідні органічні комплекси з переносом заряду.
Інтерес до провідних властивостей оксидованого поліацетилену зріс знову в сердині 1970-их, коли група професора Сіракави Хідекі випадково отримала сріблястий провідний поліацетилен. Студент, якому був доручений синтез речовини, провів його, перевищивши норму каталізатора в 1000 разів. Надалі Сіракава співпрацюваві з фізиками Аланом Хірегом та Аланом Макдіармідом, і вони разом виявили, що окиснення з використанням йоду призводить до збільшення провідності в 108 разів, наближаючи провідність до провідності найкращого з металів — срібла. Усі три отримали Нобелівську премію з хімії за 2000 рік[5][6].
Виноски
- Jozefiak, T. H.; Ginsburg, E. J.; Gorman, C. B.; Grubbs, R. H.; Lewis, N. S."Voltammetric Characterization of Soluble Polyacetylene Derivatives Obtained from the Ring-Opening Metathesis Polymerization (ROMP) of Substituted Cyclooctatetraenes" Journal of the American Chemical Society 1993; volume 115, pages 4705-4713. DOI:10.1021/ja00064a035
- Gorman, C. B. Ginsburg, E. J.; Grubbs, R. H. "Soluble, Highly Conjugated Derivatives of Polyacetylene from the Ring-Opening Metathesis Polymerization of Monosubstituted Cyclooctatetraenes: Synthesis and the Relationship Between Polymer Structure and Physical Properties" Journal of the American Chemical Society 1993, volume 115, pages 1397-1409. DOI:10.1021/ja00057a024
- Langsdorf, Brandi, L.; Zhou, Xin; Lonergan, Mark C., "Kinetic Study of the Ring-Opening Metathesis Polymerization of Ionically Functionalized Cyclooctatetraenes" Macromolecules, 2001, volume 34, pages 2450-2458. DOI:10.1021/ma0020685
- Organic Semiconductors by Yoshikuko Okamoto and Walter Brenner, Reinhold (1964). Chapt.7, Polymers, pp125-158
- Chiang, C. K.; Druy, M. A.; Gau, S. C.; Heeger, A. J.; Louis, E. J.; MacDiarmid, A. G.; Park, Y. W.; Shirakawa, H., "Synthesis of Highly Conducting Films of Derivatives of Polyacetylene, (CH)x," J. Am. Chem. Soc. 1978, 100, 1013-15. DOI:10.1021/ja00471a081
- Ebbing, Darrell; Steven Gammon (2005). General Chemistry (вид. 8th). New York: Houghton Mifflin Company. с. 1042–1043. ISBN 0-618-399410.
