Рицин
Рицин — білковий токсин рослинного походження, надзвичайно токсичний (особливо у вигляді аерозолів, для людини середня смертельна доза (ЛД50 складає 0,3 мг/кг[3] перорально). Токсичність рицина складає:
0,00015 мг/кг (білі миші, внутрішньовенно);
0,02 мг/кг (пацюки, підшкірно);
0,2 мг/кг (морські свинки, підшкірно);
| Рицин | |
 | |
| Колір | білий[1] |
|---|---|
| З матеріалу | castor beand[1] |
| Класифікація та маркування безпеки | NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response[2] |
| Наявна у таксона | рицина |
| Номер ферменту EC | 3.2.2.22 |
| Виробляється з | рицина |
| | |
Білий порошок без запаху, добре розчинний у воді. Молекулярна маса — близько 67 кДа.
Рицин, на відміну від зоокумарину, не проникає через шкіру. Шляхи отруєння — зазвичай введення в кров, трохи гірше проникає через легені (цей метод проникнення для рицина не зажди ефективний).
Біохімія
Механізм токсичної дії рицину ґрунтується на інгібування синтезу білка рибосомами. Відомі два основних типи таких інгібіторів: інгібітори типу 1 являють собою одиничний поліпептидний ланцюг, що володіє ферментативною активністю, а рицин та інші інгібітори типу 2 складаються з двох поліпептидних ланцюгів і є гетеродимерними глікопротеїдами. З них тільки ланцюг А володіє ферментативною активністю, а ланцюг B, зв'язаний з ним дисульфідними зв'язками, проявляє активність, властиву лектинам і опосредковує проникнення токсину в цитоплазму. Для того, щоб токсин міг інактивувати рибосому, дисульфидний зв'язок між ланцюгами А і В повинен бути відновленим[4].
Структура
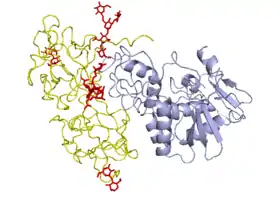
Молекула рицину являє собою Глікозильований глобулярний гетеродимер масою 60-65 кДа. Маси ланцюгів А і В приблизно рівні між собою: 32 і 34 кДа віповідно.
- Ланцюг A — N-глікозидаза, складається з 267 амінокислотних залишків[5]. Три структурних домени, що складаються з альфа-спіралей і бета-складок, утворюють щілину, в якій розміщений активний центр[6].
- Ланцюг B — лектин, складається з 262 амінокислотних залишків, зв'язує залишки галактози на поверхні клітини[7]. Утворює дводольну структуру, позбавленуАльфа-спіралі і бета-складок, кожна доля розділяється на три субдомени, один з яких містить активний центр. Білки, подібні ланцюгу A, містять різні рослини, наприклад, ячмінь, але за відсутності ланцюга B вони не токсичні.
Проникнення в цитоплазму
Здатність рицина проникати в цитоплазму залежить від водневих зв'язків, що утворюються між аміноксилотними залишкам ланцюга B і олігосахаридами на поверхні клітини, що містять залишки галактози або N-ацетилгалактозаміну. Крім того, залишки манози, що входять до складу рицину, можуть зв'язуватися з рецепторами манози на поверхні клітини[8]. Показано, що на поверхні одної клітини може зв'язуватися до 106−108 молекул рицину[9]. Після зв'язування відбувається поглинання молекул, як в клатринові везикули, так і в транспортні везикули, позбавлені клатрину, такі як Кавеоли і везикули, що утворюються при макропіноцитозі[10][11]. Так рицин потрапляє в ендосоми, а потім в апарат Гольджі. Хоча на цьому шляху рицин проходить через лізосоми, він не піддається деградації та протеолізу[12], попадаючи в подальшому незміненим з апарату Гольджі в ендоплазматичний ретикулум.
Відомо, що для виявлення токсичних властивостей рицин повинен розпастися на A- і B-ланцюги, але де це відбувається, в ендоплазматичному ретикулумі чи в цитозолі, поки невідомо[13]. Існуючий в цитозолі механізм очистки від зайвого білка шляхом його убіквінтинування на рицин також не діє, оскільки для приєднання убіквітину в його структурі бракує залишків лизіну[14].
Інактивація Рибосом
Продемонстровано, що ланцюг A розщеплює глікозидний зв'язок при залишку аденіну в позиції 4324 рРНК 28S субодниці[15][16]; цей залишок розміщений в консервативній послідовності 5’-AGUACGAGAGGA-3’, іменованій також сарцин-рициновою петлею, важливою для зв'язування факторів елонгації[17], внаслідок чого синтез білка на рибосомі повністю і незворотньо блокується. На цьому дія ланцюга A не зупиняється, кожна молекула цього ферменту виводить з ладу до 1500 рибосом за хвилину.
Виробництво
Рицин отримують з Рицинових бобів, плодів рослини Ricinus communis (латинська назва Рицина) шляхом обробки жмиху, що лишається після віджиму рицинової олії (що також містить сліди рицину).
Застосування
Медицина
На відмінну від рицинової олії, очищений рицин в медицині не застосовується, хоча проводились розробки способів його застосування для лікування раку, а також при вакцинаціях.
Хімічна зброя
Відомо, що рицин в 6 раз отруйніший ніж ціанід калію[18]. Оскільки невеликої дози рицину розмірами з вістря шпильки достатньо, щоб вбити дорослу людину, способи застосування рицину як зброї масового знищення вивчались військовими відомствами різних країн починаючи з Першої світової війни, проте з ряду причин ця речовина так і не була прийнята на озброєння. Тим не менше, рицин застосовувався спецслужбами. Одним з найбільш відомих інцидентів із застосуванням рицину стало вбивство болгарського дисидента Георгія Маркова, який був отруєний в 1978 році завдяки уколу парасолькою спеціальної конструкції[19].
Рицин включено до Списку 1 додатку до Конвенції про хімічну зброю.
Бактеріологічна (біологічна) та токсинна зброя
Рицин включено до списків:
- списку товарів подвійного використання, що можуть бути використані у створенні бактеріологічної (біологічної) та токсинної зброї товарів подвійного використання: «Номер позиції I.1.d. Найменування: ТОКСИНИ ТА ЇХ КОМПОНЕНТИ: 4) рицин»;[20]
- Групи 2. «Бактеріальні токсини», підгрупи 2.4 «Токсини з водоростей і інших рослин» списку Додатку 2: Токсини Керівництва Всесвітньої організації охорони здоров'я «Заходи системи громадської охорони здоров'я у відповідь на загрозу застосування біологічної та хімічної зброї» — 2.4.2 «Рицин»[21]
Див. також
Примітки
- http://www.cdc.gov/niosh/ershdb/emergencyresponsecard_29750002.html
- https://www.cdc.gov/niosh/ershdb/emergencyresponsecard_29750002.html
- Статья о рицине в химической экциклопедии
- Wright HT, Robertus JD (1987). The intersubunit disulfide bridge of ricin is essential for cytotoxicity. Arch Biochem Biophys 256: 280–4. doi:10.1016/0003-9861(87)90447-4.
- Olnes S, Pihl A (1973). Different biological properties of the two constituent peptide chains of ricin, a toxic protein inhibiting protein synthesis. Biochemistry 12: 3121–26. doi:10.1021/bi00740a028.
- Weston SA, Tucker AD, Thatcher DR, et al. (1994). X-ray structure of recombinant ricin A-chain at 1.8 A resolution. J Mol Biol 244: 410–22. doi:10.1006/jmbi.1994.1739.
- Wales R, Richardson PT, Robers LM, Woodland HR, et al. (1991). Mutational analysis of the galactose binding ability of recombinant ricin b chain. J Biol Chem 266: 19172–79.
- Magnusson AS, Kjeken R, Berg T (1993). Characterization of two distinct pathways of endocytosis of ricin by rat liver endothelial cells. Exp Cell Res 205: 118–25. doi:10.1006/excr.1993.1065.
- Sphyris N, Lord JM, Wales R, et al. (1995). Mutational analysis of the ricinus lectin b-chains: Galactose-binding ability of the gamma subdomain of ricinus communis agglutin b-chain. J Biol Chem 270: 20292–97. PMID 7657599. doi:10.1074/jbc.270.35.20292.
- Moya M, Dautry-Varsat A, Goud B, et al. (1985). Inhibition of coated pit formatin in Hep2 cells blocks the cytotoxicity of diphtheria toxin but not that of ricin toxin. J Cell Biol 101: 548–59. PMID 2862151. doi:10.1083/jcb.101.2.548.
- Nichols, BJ, Lippincott-Schwartz J (2001). Endocytosis without clathrin coats. Trends Cell Biol 11: 406–12. doi:10.1016/S0962-8924(01)02107-9.
- Lord MJ, Jolliffe NA, Marsden CJ, et al. (2003). Ricin Mechanisms of Cytotoxicity. Toxicol Rev 22 (1): 53–64. doi:10.2165/00139709-200322010-00006.
- Roberts LM, Smith DC (2004). Ricin: the endoplasmic reticulum connection. Toxicon 44: 469–72. doi:10.1016/j.toxicon.2004.07.002.
- Deeks ED, Cook JP, Day PJ, et al. (2002). The low lysine content of ricin A chain reduces the risk of proteolytic degradation after translocation from the endoplasmic reticulum to the cytosol. Biochemistry 41: 3405–13. doi:10.1021/bi011580v.
- Endo Y, Tsurugi K (1987). RNA N-glycosidase activity of ricin A-chain: mechanism of action of the toxic lectin ricin on eukaryotic ribosomes. J Biol Chem 262: 8128–30.
- Endo Y, Tsurugi K (1998). The RNA N-glycosidase activity of ricin A chain. J Biol Chem 263: 8735–9.
- Sperti S, Montanaro L, Mattioli A, et al. (1973). Inhibition by ricin of protein synthesis in vitro: 60S ribosomal subunit as the target of the toxin. Biochem J 136: 813–5.
- Письма с рицином: ФБР арестовало инструктора по карате - BBC Russian - В мире. Архів оригіналу за 29 квітня 2013. Процитовано 29 квітня 2013.
- Rózsa L, Nixdorff K 2006. Biological Weapons in Non-Soviet Warsaw Pact Countries. pp. 157—168. In: Wheelis M, Rózsa L, Dando M (eds.) 2006. Deadly Cultures: Biological Weapons since 1945. Harvard University Press.
- Список товарів подвійного використання, що можуть бути використані у створенні бактеріологічної (біологічної) та токсинної зброї, затверджений постановою Кабінету Міністрів України від 28 січня 2004 р. № 86 (у редакції постанови Кабінету Міністрів України від 05.042012)
- [ http://www.who.int/csr/delibepidemics/en/Annex2Ru.pdf Приложение 2 Токсины //Руководство ВОЗ «Ответные меры системы общественного здравоохранения на угрозу применения биологического и химического оружия»] (рос.)