Рівняння Ван дер Ваальса
Рівняння Ван дер Ваальса — модельне рівняння стану неідеального газу.
- .
де P — тиск, V — об'єм, N — число молекул, T — температура, kB — стала Больцмана, a та b — характерні для кожного реального газу сталі, які будуть визначені нижче.
Рівняння ван дер Ваальса описує збільшення тиску при зменшенні об'єму розріджених газів, перенасичену пару, перегріту рідину, різке зменшення стисливості в рідкій фазі. Рівняння ван дер Ваальса визначає також критичну температуру, вище якої газ не зріджується при жодному тиску. Фактично рівняння Ван дер Ваальса описує різницю між станом реального та ідеального газів. Поправки a і b мають більше значення при високих тисках газів. Наприклад, для азоту при тиску порядку 80 атм розрахунки проведені за рівняннями ідеального та реального газів різняться приблизно на 5%, а при тиску порядку 400 атм різниця складає вже 100%.
Фізична природа параметрів
Рівняння Ван дер Ваальса описує газ, молекули якого взаємодіють між собою. Потенціальна енергія взаємодії між двома молекулами задається функцією U(r), де r — відстань між молекулами. Молекули притягаються на великих відстанях і відштовхуються, підходячи близько одна до одної. Притягування зумовлене ван дер Ваальсовими силами, а відштовхування — принципом Паулі.
Нехай (подвійний радіус молекули) — відстань, починаючи з якої відштовхування змінюється притягуванням. Тоді
- .
- .
За своєю природою b — виключений об'єм, який виникає через неточковість розміру молекул. Параметр a описує притягування між молекулами на великій відстані.
Ізотерма
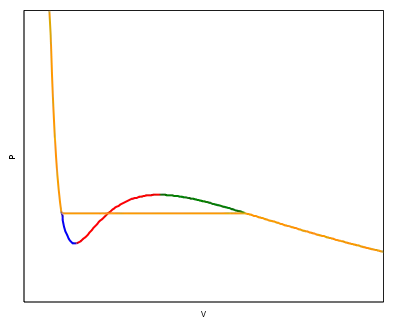
На рисунку показана типова ізотерма для рівняння ван дер Ваальса. При великих об'ємах зі зменшенням об'єму тиск збільшується.
Проте на ізотермі є ділянка (позначена червоним) для якої тиск падає зі зменшенням об'єму. Така ситуація не фізична. Збільшення тиску при зменшенні об'єму є унівенсальним законом фізики. Ця ділянка кривої не відповідає реальним фізичним станам.
У реальних газах при таких об'ємах відбуваються розшарування на дві фази: рідину й насичену пару. Експерименти з реальними газами показують, що в цій (навіть дещо ширшій області) відбувається конденсація газу й тиск залишається сталим. Відповідні стани показані жовтою горизонтальною прямою.
На кривій ізотерми ван дер Ваальса існують ще дві ділянки (позначені блакитною й зеленою кривими). Ці ділянки відповідають метастабільним станам. Зелена ділянка кривої ван дер Ваальса відповідає переохолодженому газу, тобто стану, в якому конденсація ще не розпочалася, хоча стан (горизонтальна крива), у якому краплини рідини співіснують з газом, є найстабільнішим. Метастабільний стан переохолодженої рідини можна реалізувати експериментально. Він знайшов застосування в камерах Вільсона, які служать для детектування треків заряджених часток. Проте переохолодження рідини повинно відбуватися дуже поступово й обережно. Рідина легко переходить із переохолодженого стану в стабільний стан на горизонтальній кривій.
Аналогічно, блакитним кольором показана ділянка перегрітої рідини. Перегріта рідина є метастабільним станом. Вона теж використовується в ядерній фізиці для детектування треків швидких частинок у бульбашкових камерах. Швидка частинка іонізує атоми в перегрітій рідині, й вони стають центрами швидкого утворення бульбашок
Критична температура
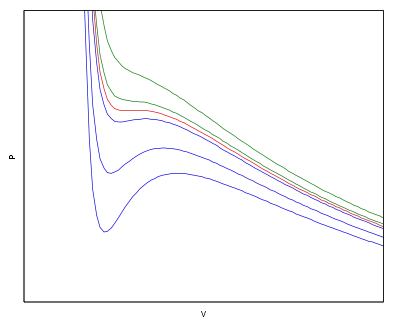
Рівняння ван дер Ваальса з успіхом пояснює той факт, що при високій температурі реальні гази не зріджуються при жодному тиску.. На рисунку справа приведено кілька ізотерм для різних температур. Червоною лініією позначена ізотерма при критичній температурі. Сині лінії відповідають температурам, нижчим за критичну. На них спостерігаються ділянки з від'ємною стисливістю. Як зазначено раніше, ці ділянки нефізичні. Насправді в реальних газах при даних умовах відбувається конденсація, тиск залишається сталим при зменшенні об'єму, міняється лише доля сконденсованого газу. Зелені лінії показують ізотерми для температур, які переревищують критичну. Вони не мають ділянок конденсації. При таких температурах гази не зріджуються.
Таблиця параметрів для реальних газів
Для опису властивостей реальних газів параметри рівняння ван дер Ваальса підбираються із експерименту.
| Газ | a [(кПа·дм6)/моль²] | b [дм³/моль] | |
|---|---|---|---|
| Гелій (He) | 3,45 | 0,0237 | |
| Неон (Ne) | 21,3 | 0,0171 | |
| Аргон (Ar) | 136,3 | 0,0322 | |
| Водень (H2) | 24,7 | 0,0266 | |
| Азот (N2) | 140,8 | 0,0391 | |
| Кисень (O2) | 137,8 | 0,0318 | |
| Повітря (80% N2, 20% O2) | 135,8 | 0,0364 | |
| Вуглекислий газ (CO2) | 363,7 | 0,0427 | |
| Вода (H2O) | 557,29 | 0,031 | |
| Хлор (Cl2) | 657,4 | 0,0562 | |
| Аміак (NH3) | 422,4 | 0,0371 | |
| Метан (CH4) | 225 | 0,0428 | |
Історія
Ян Дидерик ван дер Ваальс отримав це рівняння в 1873 році. Нобелівську премію йому присудили в 1910 році.
Джерела
- Ландау Л.Д., Лившиц Е.М. (1976). Теоретическая физика. т. V. Статистическая физика. Часть 1. Москва: Наука.
