Субталамічне ядро
Субталамічне ядро - невелике, лінзоподібне за обрисами, утворення в головному мозку. Відноситься до базальних гангліїв, основної частини екстрапірамідної системи. Як видно з назви, субталамічне ядро розташоване вентрально до таламусу. Відносно чорної субстанції воно розташовується дорсальніше, і щодо внутрішньої капсули — медіальніше. Вперше описане Жюль Бернар Люіс (Jules Bernard Luys) в 1865 році[2] , а термін corpus Luysi або Люісове тіло все ще іноді використовується.
| Subthalamic nucleus | |
|---|---|
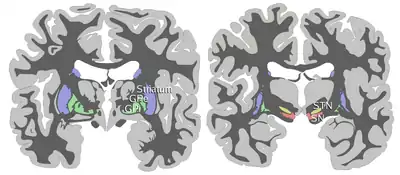 Корональні зрізи мозку людини, що показують базальні ганглії, субталамічне ядро (STN) і чорна речовина (SN). | |
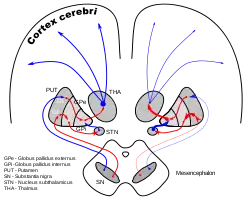 Схема зв'язків базальних гангліїв | |
| Деталі | |
| Частина від | Basal ganglia |
| Ідентифікатори | |
| Латина | nucleus subthalamicus |
| MeSH | D020531 |
| NeuroNames | 435 |
| NeuroLex ID | nlx_anat_1010002 |
| TA98 | A14.1.08.702 |
| TA2 | 5709 |
| FMA | 62035[1] |
| Анатомічна термінологія | |
Анатомія
Будова
Основні нейрони, що знаходяться в субталамічному ядрі мають довгі шипуваті дендрити.[3][4] Дендритні гілкоподібні розгалуження частіше еліпсоїдні за формою.[5] Розміри цих розгалужень (1200,600 і 300 мкм) схожі у багатьох видів, включаючи щурів, кішок, мавп і людини — як це не дивно. Однак, кількість нейронів збільшується з розміром мозку, разом зовнішніми розмірами ядра. Основні його нейрони — глутамінергічні, дякуючи цьому, вони обіймають конкретну функціональну позицію в системі базальних гангліїв. Існує також невелика кількість (близько 7,5 %) з ГАМК-ергічних інтернейронів, які беруть участь у локальних зв'язках.[6]
Аферентні аксони
Субталамічне ядро отримує основні вхідні імпульси від блідої кулі[7], частково через сочевицеподібну петлю але в основному через радіальні волокна, які перетинають спочатку медіальну частину блідої кулі (як на малюнку) і внутрішньої капсули. Ці аферентні волокна ГАМК-ергічні, гальмівні для нейронів субталамічного ядра. Збудливі, глутамінергічні вхідні імпульси надходять з кори головного мозку (особливо моторної кори), і від pars parafascicularis з центрального комплексу. Cубталамічне ядро також отримує нейромодулюючі імпульси дофамінергічних аксонів від компактної частини чорної субстанції (лат. pars compacta substantiae nigrae).[8]
Латеропалідо-гіпоталамічна система
Аксони нейронів субталамічного ядра покидають ядро з дорзального боку. Ці еферентні аксони глутамінергічні (збуджуючі). Окрім зв'язків зі стріатумом, більшість субталамічних основних нейронів є багатоцільовими й мають множинні зв'язки з іншими елементами основних базальних гангліїв.[9] Деякі з них посилають аксони до чорної субстанції медіально та до медіального і латеральної ядер блідої кулі латерально («трьохцільові», 21.3 %). Деякі з них «двохцільові» пов'язані з бічними сегментами блідої кулі і чорної субстанції (2.7 %) або латеральною й медіальною блідою кулею (48 %). Меншість нейронов «одноцільові» й пов'язані з латеральною частиною блідої кулі..[9][10] В результаті, в 82.7 % випадків, аферентація субталамічного ядра — з медіального сегмента блідої кулі
Фізіологія
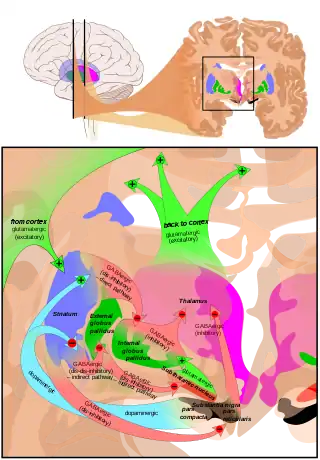
Субталамічнне ядро
Перші внутрішньоклітинні дослідження електричної активності субталамічних нейронів проводили за допомогою тонких електродів у в препараті зрізу мозку щура. На ґрунті ціх записів були зроблені три ключових дослідження, які домінували в наступних доповідях про біоелектричні властивості субталамічного ядра.
Кілька недавніх досліджень були зосереджені на автономних пейсмейкерних властивостях субталамічних нейронів, яких часто називають «швидкоспайковими пейсмейкерами» (водіями ритму),[11] , оскільки вони можуть генерувати спонтанні потенціали дії на швидкостях від 80 до 90 Гц у приматів.
Коливальна й синхронна активність[12][13], яка є, швидше за все типовим зразком біоелектричної активності нейронів субталамічного ядра, записана у пацієнтів і тваринних моделей з меншою кількістю дофамінергічних клітин у pars compacta чорної речовини, є основою патологічних змін, які лежать в основі хвороби Паркінсона.
Латеропалідарно-субталамічна система
Міцні двосторонні зв'язки поєднують субталамічне ядро й зовнішній сегмент блідої кулі, які й є по суті «швидкоспайковими пейсмейкерами». Разом, вони, як вважають, утворюють «центральний ритмоводій» базальних гангліїв"[14], з синхронними серійними розрядами потенціалів дії.
Деякі аксони з латерального сегмента блідої кулі йдуть в смугасте тіло.[15] Активність медіальної блідої кулі знаходиться під впливом аферентних волокон від латерального сегмента блідої кулі і субталамічного ядра.[16] Як і у випадку з ретикулярною часткою чорної речовини.[10] Субталамічне ядро посилає аксони до іншого регулятора — педункуло-понтінного комплексу.
Вважається͵ що латеропалідарно-субталамічна система відіграє ключову роль у генерації патернів активності, помічених при хворобі Паркінсона.[17]
Патофізіологія
Хронічна стимуляція субталамічних ядер, так звана глибока стимуляція мозку (англ. deep brain stimulation (DBS)), використовується для лікування пацієнтів з хворобою Паркінсона. Першими повинні стимулюватися термінальні розгалуження аферентних аксонів, які модерують активність таламічних нейронів. Однак, як було показано в таламічних зрізах мишей,[18] , стимул викликає також вивільнення Аденозину Трифосфату (АТФ), попередника аденозину (через катаболічний процес) сусідніми астроцитами. У свою чергу, активація ``аденозинових А1`` рецепторів пригнічує активацію нервової передачі в таламусі, імітуючи зникнення або пошкодження субталамічного ядра.
Одностороннє знищення або порушення субталамічного ядра, що може звичайно відбуватися через невеликий судинний інсульт у пацієнтів з діабетом, гіпертонією, або тривалим палінням — викликає гемібалізм.
Одна з непідтверджених функцій субталамічного ядра — контроль імпульсів, порушення котрого веде до Обсесивно–компульсивного розладу.[19] Штучна стимулюючи субталамічного ядра дає обнадійливі результати щодо корекції тяжких імпульсивних розладів поведінки й надалі може бути використана як альтернативне лікування для цього стану.[20]
Функція
Функція субталамічного ядра ще достеменно невідома, але сучасні теорії бачать його як компонент базальних гангліїв . Його дисфункція веде до збільшення імпульсивності поведінки.[21]
Дослідження показали, що субталамічне ядро — екстрапірамідний центр. Він тримає на контролі м'язові рефлекси, і його пошкодження можуть призвести до гемібалізму (від грец. ballismos — підскакування) — насильницькоих розмашистих рухів руки і ноги на одній стороні тіла.[22]
Додаткові зображення
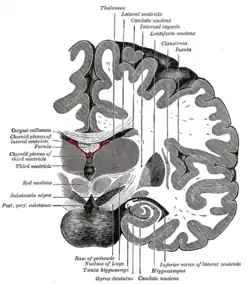 Корональний розріз головного мозку одразу навпроти мосту Субталамічне ядро позначене як "Nucleus of Luys" (ядро Люїса).
Корональний розріз головного мозку одразу навпроти мосту Субталамічне ядро позначене як "Nucleus of Luys" (ядро Люїса).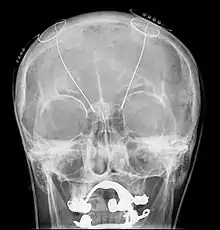 Глибока стимуляція мозку - Deep brain stimulation (DBS) з установленням "мозкового водія ритму". На рентгенограмі видні встановлені електроди
Глибока стимуляція мозку - Deep brain stimulation (DBS) з установленням "мозкового водія ритму". На рентгенограмі видні встановлені електроди
Посилання
- Foundational Model of Anatomy
- Luys, Jules Bernard (1865). Recherches sur le système cérébro-spinal, sa structure, ses fonctions et ses maladies (French). Paris: Baillière.
- Afsharpour, S. (1985). Light microscopic analysis of Golgi-impregnated rat subthalamic neurons. Journal of Comparative Neurology 236 (1): 1–13. PMID 4056088. doi:10.1002/cne.902360102.
- Rafols, J. A.; Fox, C. A. (1976). The neurons in the primate subthalamic nucleus: a Golgi and electron microscopic study. Journal of Comparative Neurology 168 (1): 75–111. PMID 819471. doi:10.1002/cne.901680105.
- Yelnik, J.; Percheron, G. (1979). Subthalamic neurons in primates : a quantitative and comparative anatomy. Neuroscience 4 (11): 1717–1743. PMID 117397. doi:10.1016/0306-4522(79)90030-7.
- Levesque J.C.; Parent A. (2005). GABAergic interneurons in human subthalamic nucleus. Movement Disorders 20 (5): 574–584. PMID 15645534. doi:10.1002/mds.20374.
- Canteras NS, Shammah-Lagnado SJ, Silva BA, Ricardo JA (April 1990). Afferent connections of the subthalamic nucleus: a combined retrograde and anterograde horseradish peroxidase study in the rat. Brain Res. 513 (1): 43–59. PMID 2350684. doi:10.1016/0006-8993(90)91087-W.
- Cragg S.J.; Baufreton J.; Xue Y.; Bolam J.P.; Bevan M.D. (2004). Synaptic release of dopamine in the subthalamic nucleus. European Journal of Neuroscience 20 (7): 1788–1802. PMID 15380000. doi:10.1111/j.1460-9568.2004.03629.x.
- Nauta HJ, Cole M (July 1978). Efferent projections of the subthalamic nucleus: an autoradiographic study in monkey and cat. J. Comp. Neurol. 180 (1): 1–16. PMID 418083. doi:10.1002/cne.901800102.
- Smith, Y.; Hazrati, L-N.; Parent, A. (1990). Efferent projections of the subthalamic nucleus in the squirrel monkey as studied by the PHA-L anterograde tracing method. Journal of Comparative Neurology 294 (2): 306–323. PMID 2332533. doi:10.1002/cne.902940213.
- Surmeier D.J.; Mercer J.N.; Chan C.S. (2005). Autonomous pacemakers in the basal ganglia: who needs excitatory synapses anyway?. Current Opinion in Neurobiology 15 (3): 312–318. PMID 15916893. doi:10.1016/j.conb.2005.05.007.
- Levy R.; Hutchison W.D.; Lozano A.M.; Dostrovsky J.O. (2000). High-frequency Synchronization of Neuronal Activity in the Subthalamic Nucleus of Parkinsonian Patients with Limb Tremor. The Journal of Neuroscience 20 (20): 7766–7775. PMID 11027240.
- Lintas A.; Silkis I.G.; Albéri L.; Villa A.E.P. (2012). Dopamine deficiency increases synchronized activity in the rat subthalamic nucleus. Brain Research 1434 (3): 142–151. PMID 21959175. doi:10.1016/j.brainres.2011.09.005.
- Plenz, D.; Kitai, S.T. (1999). A basal ganglia pacemaker formed by the subthalamic nucleus and external globus pallidus. Nature 400 (6745): 677–682. PMID 10458164. doi:10.1038/23281.
- Sato, F.; Lavallée, P.; Levesque, M. & Parent, A. (2000). Single-axon tracing study of neurons of the external segment of the globus pallidus in primate. Journal of Comparative Neurology 417 (1): 17–31. PMID 10660885. doi:10.1002/(SICI)1096-9861(20000131)417:1<17::AID-CNE2>3.0.CO;2-I.
- Smith, Y.; Wichmann, T.; DeLong, M.R. (1994). Synaptic innervation of neurones in the internal pallidal segment by the subthalamic nucleus and the external pallidum in monkeys. Journal of Comparative Neurology 343 (2): 297–318. PMID 8027445. doi:10.1002/cne.903430209.
- Bevan M.D.; Magill P.J.; Terman D.; Bolam J.P.; Wilson CJ. (2002). Move to the rhythm: oscillations in the subthalamic nucleus-external globus pallidus network. Trends in Neurosciences 25 (10): 525–531. PMID 12220881. doi:10.1016/S0166-2236(02)02235-X.
- Bekar L.; Libionka W.; Tian G.; Xu Q.; Torres A.; Wang X.; Lovatt D.; Williams E.; Takano T.; Schnermann J.; Bakos R.; Nedergaard M. (2008). Adenosine is crucial for deep brain stimulation–mediated attenuation of tremor. Nature Medicine 14 (1): 75–80. PMID 18157140. doi:10.1038/nm1693.
- Carter, Rita. The Human Brain Book. с. 58,233.
- L, Mallet; Polosan M, Jaafari N, Baup N, Welter ML, Fontaine D (2008). Subthalamic nucleus stimulation in severe obsessive-compulsive disorder.. New England Journal of Medicine 359: 2121. doi:10.1056/NEJMoa0708514.
- Frank, M.; Samanta, J.; Moustafa, A.; Sherman, S. (2007). Hold Your Horses: Impulsivity, Deep Brain Stimulation, and Medication in Parkinsonism. Science 318 (5854): 1309–12. PMID 17962524. doi:10.1126/science.1146157.
- Bruce H. Robinson (2007). Biomedicine - A textbook for Practitioners of Acupuncture & Oriental Medicine. Blue Poppy Press. с. 126. ISBN 1-891845-38-1. LCCN 2006940894.
