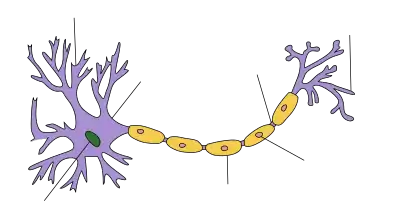
Дендрит нейрона
Дендрит (від грец. δένδρον (déndron) — дерево) — це розгалужений відросток нейрону, який отримує інформацію через хімічні (або електричні) синапси від аксонів (або дендритів і соми) інших нейронів і передає її через електричний сигнал тілу нейрона (перикаріону), від якого виростає. Термін «дендрит» ввів до наукового обігу швейцарський нейроанатом Вільгельм Гіс у 1889 році[1].
Складність і розгалуженість дендритного дерева визначає те, скільки вхідних нервових імпульсів може отримати нейрон. Тому одне із головних призначень дендритів полягає в збільшенні поверхні для синапсів, що дозволяє їм інтегрувати велику кількість інформації, яка надходить до нейрону.
На дендритах знаходяться тисячі синапсів, мембрана яких містить спеціалізовані білкові макромолекули, рецептори, що реагують на появу нейромедіаторів із пресинаптичного нейрона у синаптичній щілині. Завдяки такій унікальній та складній морфології дендрити збільшують рецептивне поле нейрону у 10-20 разів, що уможливлює значно більшу кількість синаптичних контактів (а отже і збільшує пропускну здатність) між нейронами.
Величезне різноманіття дендритних форм та розгалужень, як і відкриті нещодавно різні види дендритних потенціалзалежних іонних каналів (активних провідників) та рецепторів нейромедіаторів, є свідченням багатого репертуару обчислювальних та біологічних функцій, які дендрит може виконувати в ході обробки синаптичної інформації по всьому мозку.
З накопиченням нових емпіричних даних стає все більш очевидним, що дендрити відіграють ключову роль в інтеграції та обробці інформації, а також здатні генерувати потенціали дії та впливати на виникнення потенціалів дії в аксонах, постаючи як пластичні, активні механізми із складними обчислювальними властивостями. Дослідження того, як дендрити обробляють тисячі синаптичних імпульсів, що до них надходять, є необхідним як для того аби зрозуміти, наскільки, в дійсності, складним є один нейрон, його роль у обробці інформації в ЦНС, так і для виявлення причин багатьох психоневрологічних захворювань.
Морфологія та функції
Тіло нейрона (сома) і дендрити — це дві головні ділянки нейрону, які сприймають вхідні імпульси з інших нейронів. Згідно з класичною «нейронною доктриною», запропонованою Рамоном-і-Кахалем, інформація крізь більшість нейронів протікає в одному напрямку (ортодромічний імпульс) — від дендритних гілок і тіла нейрона (що є рецептивними частинами нейрону, до яких імпульс входить) до єдиного аксону (що є ефекторною частиною нейрону, з якої імпульс виходить). Таким чином, більшість нейронів мають два типи відростків (нейритів): один або більше дендритів, що реагують на вхідні імпульси, і єдиний аксон, що проводить вихідний імпульс. Втім, з відкриттям антидромічних імпульсів (які протікають від аксона до соми і до дендритів) та дендритних потенціалзалежних каналів, уявлення про природу дендритів почалось змінюватись.
Суттєва відмінність між дендритним деревами та іншими подібними деревоподібними структурами у природі це та, що дендритні мають більше ступенів свободи. Тож для того щоб зрозуміти вплив морфології дендритів на їх електрично-обчислювальні властивості слід брати до уваги той факт, що нейрон це тривимірна структура. Внаслідок такої складності, роль дендритної структури виходить далеко за межі просто бути місцем синаптичних контактів. Вже для Рамона-і-Кахаля було очевидним, що розгалуженість дендритів відповідає за кількість контактів, які один нейрон може мати з іншими нейронами. Нейрон, без дендритів, маючи сферичне клітинне тіло, володів би дуже обмеженою площею поверхні для отримання вхідних імпульсів. Тому дендрити є ніби розширенням тіла нейрону, збільшуючи його площу поверхні без надмірного збільшення об'єму клітини. Так, 97 % площі поверхні мотонейрону (виключаючи аксон) є дендритною.
Дендрити займають 370 000 мкм2 площі поверхні, разом з тим надаючи 300 000 мкм2 для синаптичних входів[2]. Щоб надати еквівалентну поверхню, сферичне клітинне тіло мало б мати діаметр 340 мкм, а об'єм 20 000 000 мкм3 [1].
Той факт, що 80 % площі поверхні найближчих до соми дендритів мотонейрона вкрита синапсами, свідчить, що збільшення площі поверхні дійсно є значущим для збільшення кількості вхідних імпульсів до нейрону, разом з тим дозволяючи вмістити більшу кількість нейронів в безпосередній близькості один до одного і розширити їх досяжність для більшого різноманіття аксонів від інших нейронів[2].
| Аксони | Дендрити |
|---|---|
| За рідкісними винятками, кожен нейрон має аксони. | Більшість нейронів мають дендрити. |
| Аксони з'являються першими під час нейронної диференціації. | Тільки коли аксони сформувались, починають диференціюватись дендрити. |
| Аксонні початкові сегменти відділені спеціальною плазматичною мембраною, що містить високу щільність іонних каналів і особливу організацію цитоскелету. | Дендрити неперервні з соматичною цитоплазмою і точка переходу між ними важко розрізнима. |
| Аксони, зазвичай, мають циліндричну форму із круглим або еліптичним поперечним перерізом. | Дендрити мають конусоподібну форму та невеликі відростки, шипики, що надають йому неправильний поперечний переріз. |
| Великі аксони мають мієлінову оболонку, товщина якої пропорційна розміру аксона. | Дендрити не мієловані, хоча рідко деякі з них мають кілька шарів мієліну. |
| Розмір аксону залежить від нейрофіламенту та кількості мікротрубочок, із перевагою нейрофіламентів у великих аксонах. | Дендритний цитоскелет є менш організованим, а мікротрубочки переважають навіть у великих дендритах. |
| Мікротрубочки в аксонах мають однорідну полярність, із плюс-кінцями, віддаленими від соми. | Мікротрубочки в найближчих дендритах мають змішану полярність, із плюс- та мінус-кінцями зовні спрямованими до соми. |
| Аксонні міркотрубочки збагачені тау-білками. | Дендрити можуть мати кілька тау-білків, але вони мають багато MAP2, яких нема в аксонах. |
| Зрілі аксони не мають рибосом, хоча кілька й можуть бути наявні в початковому сегменті. | В дендритах наявні ендоплазматичний ретикулум та цитоплазматичні полісоми, разом із великою кількістю специфічних мРНК. |
| Аксонні гілки віддалені від соми | Дендрити розпочинають своє розгалуження близько біля соми |
| Аксонні гілки утворюють тупі кути і мають діаметри, схожі з батьківським стовбуром. | Дендритні гілки утворюють гострі кути і мають діаметри, що є меншими від батьківського стовбуру. |
| Аксони мають пресинаптичні утворення, що знаходяться на кінці аксонних гілок. | Дендрити мають велику кількість постсинаптичних утворень, шипиків, які виходять із дендритного стовбура. |
| Потенціали дії зазвичай виникають в аксонному горбику і активно розповсюджуються від соми. | Хоча дендрити здатні генерувати потенціали дії, частіше вони модулюють електричний стан соми та початкового сегменту аксона. |
| Традиційно, аксони спеціалізовані для проведення збудження та синаптичної передачі сигналу, є нейронний «вихід». | Дендритна архітектура найкраще прилаштована для інтеграції синаптичних імпульсів з безлічі входів, є нейронний «вхід». |

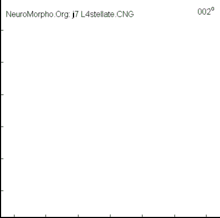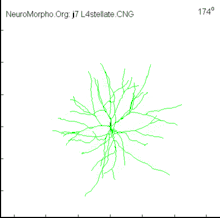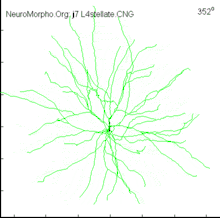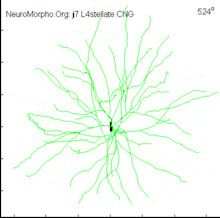
Структура і типи
На відміну від аксонів, дендрити мають високий вміст рибосом і утворюють відносно локальні з'єднання, неперервно галузяться у всі сторони та звужуються, що веде до зменшення в розмірах дочірніх відростків на кожній гілці. Також, на відміну від рівної поверхні аксонів, поверхня більшості дендритів усіяна виступаючими маленькими органелами, які називаються дендритними шипиками і які володіють високою пластичністю: здатні народжуватись і гинути, змінювати свою форму, об'єм і кількість протягом короткого відрізку часу. Серед дендритів є ті, які усіяні шипиками (пірамідні нейрони), як і ті, які шипиків не мають (більшість інтернейронів), досягаючи максимальної кількості шипиків у клітинах Пуркіньє — 100 000 шипиків, тобто близько 10 шипиків на 1 пм. Інша відмінна риса дендритів в тому, що вони характеризуються різною кількістю контактів (аж до 150 000 на дендритному дереві у клітині Пуркіньє) та різними типами контактів (аксон-шипик, аксон-стовбур, дендро-дендритні).
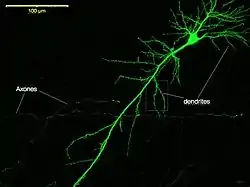
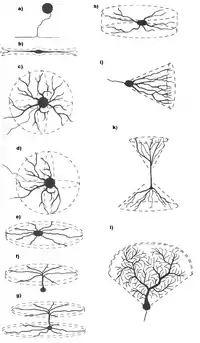
Одна з прийнятих, але і найважчих, в нейробіології класифікацій нейронів (започаткована Кахалем) ґрунтується на їх дендритній структурі і густоті. Однак, з іншого боку, є нейрони, які не мають дендритів («адендритні нейрони»), але тільки розгалужені аксони (наприклад, нейрони чутливих вузлів спинномозкових нервів симпатичного ганглія), а є нейрони із надто складними дендритами. До нейронних типів із найбільш характерними дендритними формами належать[1]:
- Біполярні нейрони, в яких два дендрити відходять в протилежних напрямках від соми;
- Деякі інтернейрони, в яких дендрити розходяться у всіх напрямках від соми;
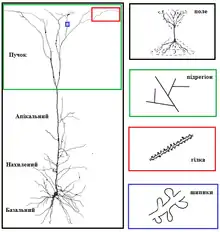
- Пірамідні нейрони (також відомі, як біконічні), — головні збуджувальні клітини у мозку, — що мають характерну пірамідну форму клітинного тіла і в яких дендрити поширюються в протилежні сторони від соми, покриваючи дві перевернуті конічні площі: вверх від соми простягається великий апікальний дендрит, що піднімається крізь шари, а вниз — безліч базальних дендритів, які простягаються латерально.
- Клітини Пуркіньє у мозочку, дендрити яких виходять із соми у формі плоского віяла.
- Зірчасті нейрони, дендрити яких виходять з різних боків соми, утворюючи форму зірки.
У зв'язку із великою кількістю типів нейронів і їхніх дендритів, доцільно розглянути морфологію дендритів на прикладі одного конкретного нейрону — пірамідної клітини. Пірамідні нейрони знаходяться в багатьох регіонах мозку ссавців: гіпокамп, мигдалина, неокортекс. Ці нейрони є найбільш рясно представлені в корі головного мозку, складаючи більше ніж 70-80 % всіх нейронів ізокортексу ссавців. Найбільш популярними, і тому краще дослідженими, є пірамідні нейрони 5-го шару кори: вони отримують надзвичайно потужний потік інформації, що пройшла через різні попередні шари кори, і мають складну структуру на поверхні м'якої мозкової оболони («апікальний пучок»), яка отримує вхідні імпульси із ієрархічно відокремлених структур; далі ці нейрони надсилають інформацію до інших кіркових і підкіркових структур. Хоча, подібно до інших нейронів, пірамідні клітини мають апікальні та базальні дендритні пучки, їм також притаманні додаткові відростки вздовж апікальної дендритної осі — це так званий «нахилений дендрит», який раз або двічі розгалужується від основи. Особливістю дендритів пірамідальних нейронів є також те, що вони можуть надсилати ретроградні сигнальні молекули (наприклад, ендоканабіноїди), які проходять в зворотному напрямку крізь хімічний синапс до аксону пресинаптичного нейрону[4].
Хоча часто дендритні гілки пірамідних нейронів порівнюють із гілками типового дерева, вони такими не є. Тоді як діаметр гілок дерева поступово звужується з кожним поділом і стає все більш коротким, діаметр кінцевої гілки дендрита пірамідальних нейронів є значно тоншим аніж її батьківська гілка і ця кінцева гілка часто є найдовшим сегментом дендритного дерева. Тим більше, діаметр кінцевого дендрита не є звуженим, на відміну від апікального стовбура чи гілок дерева: він має менше 1 мкм в діаметрі, як в точці з'єднання з головним апікальним стовбуром, так і на своєму віддаленому кінці, у 100 мкм від стовбура. Така унікальна геометрія дендрита добре підходить для електричної сегментації та окремої обробки інформації в цих сегментах, оскільки тут синаптичні струми зібрані із відносно великої площі в межах регіону з високим опором. Тож навіть відносно невеликий синаптичний струм, що надходить в дендритне закінчення генерує тут значну деполяризацію, достатню для породження локального дендритного потенціалу дії[5].
Розгалуження
Своєю функціональністю та високою рецептивністю дендрити завдячують складній геометричній розгалуженості. Дендрити одного нейрону, взяті разом, називаються «дендритним деревом», кожна гілка якого називається «дендритною гілкою». Хоча інколи площа поверхні дендритної гілки може бути досить великою, найчастіше дендрити перебувають у відносній близькості від тіла нейрона (соми) з якого виходять, сягаючи в довжину не більше 1-2 мкм. Кількість вхідних імпульсів, які даний нейрон отримує, залежить від його дендритного дерева: нейрони, що не мають дендритів, контактують лиш з одним чи кількома нейронами, тоді як нейрони із великою кількістю розгалужених дерев здатні приймати інформацію від безлічі інших нейронів. Найбільш складну і красиву дендритну форму мають клітини Пуркіньє, дерево на яких має близько 400 верхівок, тоді як α-мотонейрони в спинному мозку кішки мають лише 8-12 дендритних дерев, кожне з близько 30 верхівками[6].
Рамон-і-Кахаль, вивчаючи дендритні розгалуження, дійшов висновку, що філогенетичні відмінності в специфічній нейронній морфології підтримують відношення між дендритною складністю і кількістю контактів[7]. Складність та розгалуженість багатьох типів нейронів хребетних (як то пірамідні нейрони кори, клітини Пуркіньє мозочка, мітральні клітини нюхових цибулин) зростає із збільшенням складності нервової системи. Ці зміни пов'язані як із потребою для нейронів формувати більше контактів, так і з необхідністю контактувати із додатковими нейронними типами в конкретному місці нейронної системи.
Відтак, спосіб зв'язаності між нейронами є однією з найбільш фундаментальних властивостей їх багатоманітних морфологій[8], і саме тому дендрити, які формують одну з ланок цих зв'язків, визначають різноманіття функцій та складність конкретного нейрону.
Втім, морфологія дендритів визначає не тільки кількість і тип контактів, які може утворити даний нейрон з іншими нейронами, але і його обчислювальні операції. Як моделювання, так і електрофізіологічні дослідження поведінки нейронів in vitro та in vivo, продемонстрували, що нейрони з більш складною морфологією (більші і розгалуженіші дендритні дерева, більше гілок і шипиків) характеризуються пачковою пульсацією, тоді як нейрони із простішою морфологією мають тенденцію до тонічних спайків[9][10]. Також морфологія дендритів має суттєвий вплив на поширення потенціалу дії, виявлення дендритами збігів у вхідних синаптичних імпульсах[11][12].
Тривимірний розподіл дендритних гілок також має важливе значення для визначення типу інформації, яка надходить до нейрону. Тоді як нейрон із дендритними деревами, локалізованими лише в даному шарі кори, може отримати дуже обмежену кількість та різноманітність контактів, то нейрони із розширеними дендритними гілками, що сягають інших шарів (наприклад, як великі пірамідні нейрони), здатні отримувати значно різноманітніші та складніші вхідні імпульси[13].
Але розгалуженість та різноманіття дендритної морфології також має і обмежувальний вплив на нейронні обчислення, зокрема на ефективність вхідних синаптичних імпульсів (синаптичну інформаційну ефективність, SIE[14]): нейрони з більш розгалуженими дендритними деревами характеризуються більш різким та швидким зменшенням синаптичної ефективності (амплітуди синаптичних потенціалів) вздовж шляху від віддаленого місця синаптичного входу до соми, що призводить до загасання постсинаптичного потенціалу[15]. Втім, значна нелінійність дендритів, — яка зумовлена наявністю потенціалзалежних іонних каналів, — здатна подолати це загасання, підтримуючи та підсилюючи імпульс на різних рівнях дендритного дерева[16].
Діаметр і довжина
Діаметр дендритів близько біля соми має кілька мкм, стаючи меншим 1 мкм коли вони поступово гілкуються. Багато типів дендритів усіяні безліччю крихітних відростків, дендритними шипиками, які утворюють надзвичайно тонкі (~0,1 мкм) і короткі (1 мкм) дендритні гілочки. Ці шипики є головною мішенню для збудливих синаптичних входів і відіграють важливу роль у нейронній пластичності. Довжина самих дендритних дерев коливається від надзвичайно коротких (100—200 мкм, як у шипикових зірчастих клітинах кори ссавців) до досить великих (1-2 мм, як у спинному α-мотонейроні). Загальна довжина дендрита може досягати 104 мкм (1 см) і більше[17][18].
В цілому, дендрити (не враховуючи шипики) займають приблизно такий же об'єм кори, як і аксони (без включення тіла клітин та кровоносних судин) (на прикладі кори миші)[19]:
| Аксони | 34 % |
| Дендрити | 35 % |
| Шипики («шия» та «голова») | 14 % |
| Глія | 11 % |
| Позаклітинний простір | 6 % |
В деяких регіонах ЦНС сусідні дендритні дерева тісно переплітаються, дуже часто ділячи між собою ту саму область і групу аксонів, з якими формують синаптичні контакти. Це особливо характерно для дендритів пірамідних нейронів в корі, тоді як в інших регіонах мозку дендритні дерева (наприклад, клітин Пуркіньє в мозочку) відокремлені один від одного і не перекриваються, кожне маючи свої індивідуальні синаптичні контакти. Саме тому на прикладі пірамідних клітин найкраще помітно значний вплив морфології дендритів на складність нейронних операцій.
Якщо припустити, що дендрити мають циліндричну форму і середній діаметр 0,9 мкм (на основі даних електронної мікрофотографії), то дендритна довжина в 1 мм3 складатиме 456 м, що майже на порядок величини менше, аніж аксонна довжина в тому самому об'ємі, ілюструючи більшу середню товщину дендритів. Відтак, 9,2×104 нейронів в 1 мм3 відповідало б ~276-460 м дендритів в 1 мм3 [20].
З цього випливає, що в системі зв'язків між пірамідними нейронами, яка включає більшість синапсів кори, вплив одного нейрона на інший є досить слабким, опосередковуючись здебільшого одним синапсом. Це означає, що скільки кожен кортикальний пірамідний нейрон має синапсів (а це ~4000) зі стількома ж іншими пірамідними нейронами він утворює контакти[21].
Подібному максимальному розходженню сигналів від однієї клітини до тисяч інших відповідає таке ж максимальне сходження: тисячі синапсів на дендритному дереві однієї пірамідної клітини (при 3,3 синапсах на мкм дендритної довжини) формують контакти із аксонами стількох же різних пірамідних клітин[22].
Така унікальна дендритна морфологія пірамідних клітин, яка дозволяє їм формувати не схожу на інші нейрони мережу контактів, привела деяких дослідників до думки, що «кора постає, як „пристрій“ для найбільш широкого розповсюдження та найбільш глибинного змішування сигналів, сумісного з природними обмеженнями нервових клітин»[20][23][24].
Фізіологія
Морфологія дендритів надає їм унікальні електричні та пластичні властивості, і, як наслідок, обумовлює варіації в обчислювальних властивостях самих нейронів. Якщо, наприклад, розглядати дендрити як пасивні провідники (класичне уявлення), то різноманітна дендритна морфологія впливає лише на частоту нейронного розряду (firing). Однак, якщо розглядати активну електричну провідність в дендритах (сучасне уявлення), то стає очевидним вплив морфології дендритів: виникає варіація розрядів між пачками (bursts) та регулярними формами пульсації[25][26], чи відбувається вплив на зворотне поширення потенціалів дії[27].
Електрично, дендрити можуть бути охарактеризовані через їх пасивні властивості («кістяк»), до яких додані (нелінійні) синаптично- і потенціал-залежні іонні канали. Пасивний (близький до потенціалу спокою) кістяк дендрита характеризується питомим мембранним опором, Rm дендритів, який є відносно високим (1000—100 000 Ω•см2), що означає, дендритна мембрана є діелектриком високого спротиву. Із питомою ємністю, Cm в приблизно 1 мкФ/см2, мембранна часова стала, τm (яка визначає часовий інтервал для інтеграції синаптичних вхідних імпульсів) є порядку τm = RmCm = 10-100 мс. Залежно від типу і морфології, площа поверхні мембранного дендритного дерева коливається від 20 000 до 750 000 мкм2, об'єм може досягати до 30 000 мкм3, довжина — 10 мм (напр., в поперекових мотонейронах). Внутрішньоклітинна цитоплазма та зовнішньоклітинне середовище дендритів містить іони, які здатні проводити електричний струм[28]. Дендритна мембрана також здатна проводити струм через специфічні трансмембранні іонні канали, але струм, який проходить через мембрану зустрічає значно більший опір, аніж вздовж внутрішньої серцевини. Окрім мембранних каналів (мембранний опір), дендритна мембрана здатна накопичувати іонні заряди, тобто функціонувати, як конденсатор.
Осьовий (поздовжній) опір дендритної цитоплазми, Ri, коливається від 70 до 300 Ω•см, що разом із малими вимірами віддалених гілок, передбачає великий вхідний опір (імпеданс) в дендритах. Збільшення дендритного діаметра з наближенням до соми означає великий коефіцієнт загасання (~100) пікового синаптичного потенціалу, коли той поширюється від початку у віддаленій дендритній точці до соми. Мембранний та цитоплазматичний питомий опір обумовлюють також внутрішній опір Rin в кожній даній точці на дендритному дереві: Rin може змінюватись від 1 MΩ (товщі та більш проникні дендрити) до 1000 MΩ (тонкі відростки, як шипики). Найбільші значення Rin в дендритах передбачають, що мала збуджувальна синаптична зміна провідності (~1 нСм) приведе, локально, до значної (в кілька десятків мВ) зміни потенціалу[29].
Дендрити, відтак, є електрично розподіленими «механізмами», тож нейрони не є еквіпотенціальними, — як їх моделювали в класичних теоріях, — бо між різними регіонами дендритного дерева (і соми) може існувати десятикратна різниця напруг, як результат локального синаптичного входу до дендритів
| Нейрон | Середній діаметр соми (мкм) | К-сть дендритів на сомі | Діаметр близьких до соми дендритів (мкм) | Кількість точок розгалуження | Діаметр віддалених від соми дендритів (мкм) | Протяжність дендритуא (мкм) | Загальна довжина дендрита (мкм) |
|---|---|---|---|---|---|---|---|
| Гранулярні клітини мозочка (кішка) | 7 | 4 | 1 | 0 | 0,2-2 | 15 | 60 |
| Зірчасті амакринові клітини (резус) | 9 | 1 | 1 | 40 | 0,2-2 | 120 | -- |
| Гранулярні клітини зубчастої звивини (щур) | 14 | 2 | 3 | 14 | 0,5-1 | 300 | 3200 |
| CA1 пірамідна клітина (щур) | 21 | — | — | — | — | — | 11,900 |
| базальні дендрити | — | 5 | 1 | 30 | 0,5-1 | 130 | 5500 |
| s.radiatum | — | 1 | 3 | 30 | 0,25-1 | 110 | 4100 |
| s.lacunosum-moleculare | — | — | — | 15 | 0,25-1 | 500 | 2300 |
| Клітини Пуркіньє мозочка (морська свинка) | 25 | 1 | 3 | 440 | 0,8-2,2 | 200 | 9100 |
| Довгоаксонна клітина блідої кулі (людина) | 33 | 4 | 4 | 12 | 0,3-0,5 | 1000 | 7600 |
| Клітини Мейнерта зорової кори (макака) | 35 | — | — | — | — | — | 15 400 |
| базальні дендрити | — | 5 | 3 | — | — | 250 | 10 200 |
| апікальні дендрити | — | 1 | 4 | 15 | 2-3 | 1800 | 5 200 |
| Альфа-мотонейрон спинного мозку (кішка) | 58 | 11 | 8 | 120 | 0,5-1,5 | 1100 | 52 000 |
א Середня відстань від тіла клітини до кінчиків найдовших дендритів
Дендритні синапси
_and_massive_aggregation_of_polyribosomes_(black)..jpg.webp)
Хоча дендрити прилягають до багатьох аксонів та інших дендритів, передача сигналу відбувається головним чином в синапсах. Синапси можуть перебувати безпосередньо на поверхні дендриту (т. зв. стовбурові синапси), або на дендритних шипиках.
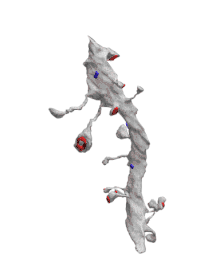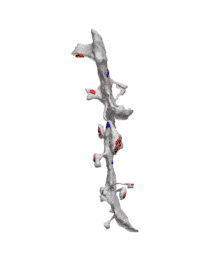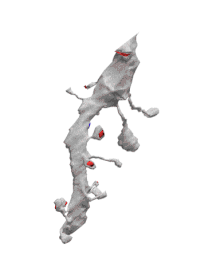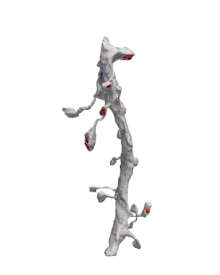
До 1960-х вважалось, що взаємодія в нервовій системі є односторонньою — від аксона до дендрита до соми і що тільки аксони можуть бути пресинаптичними. Відповідно до цього уявлення виділяли такі синаптичні зв'язки, як: аксо-дендритні (між аксоном і дендритом), аксо-соматичні (між аксоном і клітинним тілом), аксо-аксонні (між двома аксонами) і аксо-шипикові (між аксоном і шипиком)[30]. Але в 1966 році, Вілфрід Ролл теоретично передбачив, а його колеги надали фізіологічні докази існування нового і неочікуваного синаптичного зв'язку, який вони виявили в нюховій цибулині — дендро-дендритного синапса. Ці синапси утворюються між дендритами мітральної та гранулярної клітин. Обидва компонента синапса є дендритними по своїй природі, але ще більш дивним було те, що самі ці синапси є реципрокними (взаємообумовлюючими), тож обидві клітини діяли як пресинаптичні нейрони[31].
Це відкриття було настільки одночасно незвичним і важливим, що десятиліття після його публікації нейробіологи згадували про нього, як «тиху революцію» у розумінні нейронів та дендритів: «Нове уявлення про нейрон [яке випливає з цього відкриття], полягає в тому, що дендрит це аж ніяк не пасивна рецептивна поверхня, але також може поставати пресинаптичним, таким, що передає інформацію до інших нейронів через дендроденритні синапси»[32]. Інший рідкісний випадок синаптичного контакту, це «autapse», коли аксон утворює синапс із власним дендритним деревом, але цей тип зв'язку наразі мало зрозумілий[31].
Синапси не є хаотично розподілені на дендритній поверхні. В багатьох системах (пірамідних клітинах гіпокампу чи клітинах Пуркіньє в мозочку) джерело синаптичного імпульсу вибірково спрямовується на даний регіон дендритного дерева, аніж просто випадково розподіляється по поверхні дендритного дерева. До прикладу, в корі ~79 % всіх збуджувальних синапсів знаходяться на шипиках, а інші — на дендритних стовбурах, тоді як всього лише 31 % всіх гальмівних синапсів локалізовані на шипиках. Тим більше, що шипик із гальмівним синапсом завжди також має збуджувальний синапс: ~15 % всіх дендритних шипиків мають як збуджувальні, так і гальмівнісинапси. Гальмівні синапси частіше локалізуються на сомі або на стовбурі дендритного дерева[20]. Внаслідок такої локалізації, всього декілька гальмівних вхідних імпульсів можуть шунтувати весь вхідний збуджувальний імпульс, що збирався дендритним деревом із сотень синапсів апікальних дендритів. Цей феномен називається «інгібіторне шунтування»[30].
Загалом прийнято виділяти кілька синаптичних типів на дендритах[33]:
- Varicosities (варикозно розширені) — синапси, найбільше яких на амакринових клітинах сітківки, а також серед деяких інтернейронів.
- Filopodia (філоподії). Всі нейрони короткий час мають дендритні філоподії протягом розвитку: вони є дуже динамічними, розширюючись та втягуючись протягом кількох хвилин. Однак після періоду розвитку нейрона філоподії зникають, відтак, беручи роль у синаптогенезі (формуванні синапсів між нейронами), часто утворюючи слабкі контакти. Після розвитку нейрона філоподії заміняються стовбуровими синапсами.
- Synaptic crests (синаптичні гребінці) формуються двома аксонами з обох сторін тонкої ламелярної шиї гребінця.
- Thorny excrescences (тернисті нарости) утворюють 90 % дендритних відростків на близьких до соми апікальних дендритах.
- Rasemose appendages (китицеподібні відростки)
- Corralline excrescenec (коралові відростки)

Шипики
Вирішальним чинником для здатності нейронної мережі зберігати інформацію є кількість різних нейронів, що можуть бути синаптично з'єднані[34]. Одним з головних чинників збільшення різноманіття форм синаптичних зв'язків у біологічних нейронах є існування дендритних шипиків, відкритих 1888 року Кахалем[7]. Він же вперше висунув припущення, що шипики виконують функцію збільшення поверхні для синаптичних контактів з аксонами, що знаходяться на далекій відстані від дендритів: «…дендритні шипики відіграють головну роль у збільшенні поверхні з'єднань протоплазматичного розгалуження [тобто, дендритного дерева], виступаючи, щоб з'єднатись з віддаленими нервовими волокнами, які не можуть безпосередньо з'єднатись із дендритним відростком.»[7]
У 1904 році Кахаль зробив припущення, що шипики можуть зберігати електричний заряд, що виникає в результаті нейронної активності, тим самим заклавши основи розуміння синаптичної пластичності[7]. Як показали пізніші дослідження, шипики розширюють доступність даного дендрита для більшої кількості аксонів, при цьому не надто збільшуючи об'єм мозку. Хоча більшість шипиків містять один синапс, існують шипики з кількома синапсами. Відношення реального синапса до числа потенційних синапсів (т. зв. коефіцієнт заповнення) для пірамідних нейронів кори дорівнює 0,26 у неокортексі і 0,22-0,34 у гіпокампі[35]. Це означає, що дендритні шипики відіграють суттєву роль у визначенні того, які аксони утворюють контакти з дендритом[36].
Шипики знайдені в різних місцях нейронної системи, не тільки в корі головного мозку, а в деяких випадках, як наприклад, на клітинах Пуркіньє в мозочку, вони майже схожі до кіркових шипиків. Втім, найбільш важливі вони в корі головного мозку, оскільки тут вони пов'язані із 75 % всіх синапсів[20].
Різні регіони дендритних гілок мають різну щільність шипиків. До прикладу, CA1 пірамідні нейрони в щура мають 30,000 шипиків, 55 % яких зосереджені в stratum radiatum, а 40 % — в stratum oriens. Щільність шипиків на латеральних гілках апікального стовбура в stratum radiatum досягає, в середньому, 3 на 1 мкм дендриту[37]. Віддалені дендрити базального конуса мають подібну щільність шипиків, тоді як в нижчому апікальному пучку їх щільність значно нижча. Апікальний стовбур в stratum radiatum сам по собі має найбільшу щільність шипиків — 7 шипиків на 1 мкм[38]. Найбільш близькі від соми дендрити пірамідного нейрона отримують гальмівні вхідні імпульси, тому ці регіони, так само як і сома, позбавлені шипиків. У дорослого мозку щільність простих шипиків значно варіюється, від 0,01 мкм3 до більш ніж 1,5 мкм3 [37]. Той факт, що різні регіони дендритної гілки мають різну щільність шипиків свідчить про відмінності у з'єднаннях з різними збуджуючими вхідними синапсами[18].
Діаметр шипиків коливається від 0,1 до 0,4 мкм, а довжина від 0,4 до 2 мкм. В більшості регіонів мозку, шипики мають два входи — збуджуючий та гальмівний. Втім, в полі CA1 гіпокампа, кожен шипик пірамідної клітини має тільки один синапс, збуджуючий[36].
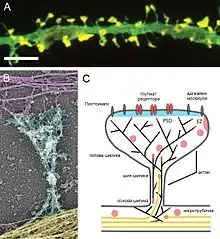
Дендритні шипики формують біохімічний та електричний сегмент, де сигнали, що надходять, вперше інтегруються та обробляються. Шия шипика розділяє його голову від іншої частини дендрита, тим самим роблячи шипика окремим біохімічним та обчислювальним регіоном нейрона. Подібна сегментація відіграє ключову роль у вибірковій зміні сили синаптичних зв'язків протягом навчання та запам'ятовування[34][39]. Із шипиками також пов'язані патологічні зміни, оскільки їх щільність зменшується при багатьох вікових та психоневрологічних захворюваннях, (як деменція, хронічний алкоголізм, шизофренія, трисомія)[38].
У нейробіології також є прийнятою класифікація нейронів на основі існування шипиків на їх дендритах. Ті нейрони, які мають шипики, називаються шипиковими нейронами, а ті, які їх позбавлені — безшипиковими. Між ними існує не тільки морфологічна відмінність, але й відмінність у передачі інформації: шипикові дендрити найчастіше є збуджувальними, а безшипикові — гальмівними[30].
Хоча шипики важко вивчати за фізіологічних умов, накопичено низку даних, які дозволяють зробити припущення про існування різних популяцій стабільних та більш пластичних шипиків in vivo і що ці популяції можуть змінюватись з досвідом[40]. Існує кілька здогадів, що саме ці, динамічні шипики можуть брати участь в навчанні, тоді як більш великі, стабільні шипики можуть виконувати роль зберігачів накопичених спогадів[41]. Повторювана активація малих шипиків веде до тривалого збільшення в їх розмірах та сприйнятливості до глутамату[42]. І навпаки, незначна активація AMPA-рецепторів стабілізує шипики, натякаючи на подвійну роль активації глутамат-рецептора в підтримці структурної пластичності[33].
На відміну від дендритів, шипики також швидше реорганізуються і змінюються[43]. Їх пластичність залежить від актинових ниток і скоріш за все корелює з навчанням[44]. Багаті актином шипики характеризуються особливими морфологічними змінами, що пов'язані із довготривалою потенціацією (LTP) і відіграють ключову роль в навчанні[45][46].
| Морфологія | Фізіологія | Синаптологія |
|---|---|---|
| Діаметр біля соми: 1-6 мкм | Пасивні властивості дендритів | К-сть синапсів/нейрон: 500—200 000 |
| Діаметр на віддалених кінцях: 0,3-1 мкм | Мембранний опір (Rm): 1-100 кΩ•см2 | Тип І (збуджувальні): 60 %-90 %, головним чином на шипиках |
| Середня довжина шляху: 0,15-1,5 мм | Осьовий опір (Ri): 70-300 Ω•см2 | Тип II (гальмівні): 10 %-40 %, біля соми, лише деякі на шипиках |
| Загальна дендритна довжина: 1-10 мм | Мембранна ємність (Cm): 1-2 мкФ/см2 | |
| Дендритна площа: 2000—750 000 мкм2 | Мембранна часова стала (τm): 1-100 мс | Збуджувальний синаптичний вхідний імпульс: |
| Дендритні дерева/нейрон: 1-16 | Дендритна просторова стала (λ): 0,2-1 мм | AMPA: gпік: 0,1-0,3 нс: tпік: 0,3-1 мс |
| Дендритні кінці/нейрон: 10-400 | Електротонічна довжина (L = x/λ): 0,2-2 | (може збільшуватись з відстанню від соми) |
| Дендритні шипики/нейрон: 300—200,000 | Вхідний опір соми (RN): 1-103 ΩM | NMDA: gпік: 0,05-0,5 нс: tпік:5-50 мс |
| Щільність шипиків/1 мкм дендрит: 0,5-14 | Вхідний опір на кінцях (RT) 102−103 ΩM | |
| Довжина шипика: 0,1-2 мкм | Коефіцієнт загасання напруги: | Гальмівний синаптичний вхідний імпульс: |
| Діаметр шиї шипика: 0,04-0,5 мкм | сома → кінець: 1,1-2 | ГАМКА: 0,4-1 нс; tпік: 0,2-1,2 мс |
| Діаметр голови шипика: 0,3-1 мкм | кінець → сома: 2-15 | ГАМКB: 0,1-0,3 нс; tпік: 40-150 мс |
| Об'єм шипика: 0,0005-0,3 мкм2 | ||
| Активні властивості дендритів | ||
| Ca2+ канали (L, N, P типи) — локальний дендритний Ca2+ спайк | ||
| Ca2+концентрація в шипиках | ||
| Na+ канали: Швидка активація/інактивація — підтримує | ||
| сому → дендритний зворотнопоширюючийся ПД | ||
| K+ канали, IA, та змішані струми, Ih — Збільшення | ||
| щільності з відстанню від соми — «поглиначі ударів», нелінійність, часове нормування |
Дендритний потенціал поля (DFP)
Пірамідні нейрони мають довгий дендритний стовбур, який відділяє збуджувальні синапси на апікальному дендритному дереві від гальмівних синапсів на базальних дендритах та сомі, утворюючи так зване «відкрите поле», в якому дендрити повернені в одному напрямку, а соми в іншому. Крім того, ці клітини характеризуються осьовою симетрією та розташовані в ряд паралельно один до одного і перпендикулярно до поверхні кори, формуючи палісад із клітинних тіл та дендритних стовбурів. Коли обидва типи синапсів активні одночасно, то гальмівні синапси породжують джерела струму (з клітини до позаклітинного простору), а збуджувальні — струми стоку (із позаклітинного простору в клітину), змушуючи пірамідну клітину поводитись як мікроскопічний диполь, оточений характерним полем, — дендритним потенціалом поля (DFP). Щільно прилеглі одна до одної пірамідні клітини утворюють дипольний шар, накладені струми якого породжують потенціал локального поля (LFP) нейронних популяцій кори, який може бути реєстрований з допомогою ЕЕГ[47].
Вважається, що просторова сумація LFP відображає середнє зважене збуджувальних та гальмівних постсинаптичних потенціалів, які є повільнішими, аніж потенціали дії. Хоча вже довгий час вважається, що LFP визначається переважно синхронізованими дендритними вхідними сигналами на пірамідних клітинах, але ще сьогодні неясно, як саме і наскільки кореляції в синаптичній активності впливають на LFP[48].
Пасивна електрична провідність
Протягом кількох десятиліть — незважаючи на їх морфологічну складність — дендритні дерева моделювались при розрахунках, як єдина точка і розглядались більшістю нейробіологів як прості і пасивні механізми передачі сигналів (зміна мембранного потенціалу) до соми, яка ці сигнали інтегрує в лінійний спосіб і відсилає до аксону, який і генерує потенціал дії[49]. Втім, незабаром стало очевидним, що пасивні властивості дендритів, разом з їх складною геометрією, дозволяють нейронам інтегрувати їх вхідні імпульси в нелінійний спосіб.
Електротонічний потенціал
Аби зрозуміти, який саме внесок роблять дендрити у нейронну обробку інформації згідно з уявленням дендриту, як пасивного механізму, слід мати на увазі, що нейрони генерують два типи електричних потенціалів: електротонічний потенціал і потенціал дії. Електротонічний потенціал — це локальний потенціал, який не розповсюджується активно, але пасивно поширюється внаслідок зміни в іонній провідності (сенсорній або синаптичній, яка породжує електричний струм).
Вілфрід Ролл у 1960-х роках[50][51] для опису пасивного електротонічного потенціалу, що експоненційно зменшується проходячи уздовж ділянки мембрани, використав більш широкий термін «поширення» (spread), що позначав локальні струми, які існують до потенціалу дії; цей термін по своїй широті також може застосовуватись і до потенціалу дії. Тоді як для опису власне потенціалу дії Ролл використовував термін «розповсюдження» (буквально «розмноження») (propagation), оскільки він точніше відповідає сутності потенціалу дії: проходження послідовними активними процесами відтворення самого себе. Отож, електротонічні сигнали (напр., струм або потенціал) — це сигнали, які не обумовлені активними, потенціал-залежними властивостями мембрани, але її пасивними, RC властивостями. Однак, з відкриттям перших потенціал-залежних іонних каналів в дендритах і їх здатності породжувати ПД (див. далі), стало очевидним що не всі дендрити підходять під термін «електротонічні», але тим не менше він виявився досить корисним для розуміння дендритної електричної провідності і широко використовується понині.
Кабельна теорія дендритів
Розуміння того, як інформація сприймається та кодується активними дендритними деревами неможлива без розуміння моделі пасивних дендритів. Більше того, за певних умов, напр., для малого синаптичного вхідного імпульсу, потенціалзалежні нелінійності не відіграють значної ролі і дендрит діє як пасивна структура.
В 1960-х та 1970-х роках американський математик та нейронауковець Вілфрід Ролл із Національного інституту здоров'я в серії статей,[17][50][51][52][53][54] вперше застосував кабельну теорію для опису біофізичних та інтегративних функцій дендритів[55]. В ті часи вважалось, що дендрити є настільки електротонічно довгими, що будь-які вхідні імпульси до них не можуть суттєво впливати на електричні властивості соми[56]. Утім, поєднавши математичну кабельну теорію та ті незначні фізіологічні дані, які в той час існували, Ролл переконливо показав, що класичні уявлення про дендрити суттєво недооцінюють їх значний внесок у нейронні обчислення та передачу інформації[57].
Звівши складну морфологію дендритів до «еквівалентного циліндра», кабельна теорія Ролла вперше змогла описати електричні та обчислювальні властивості пасивних дендритних дерев з будь-якою складністю, зокрема аналітично вичислити чутливість напруги в довільній точці дендритного дерева до струму, поданого в будь-якій іншій точці. Це дало можливість оцінити амплітуду синаптичного потенціалу і його залежність від часу в даному дендритному місці, як і виявити, що кабельні властивості дендритів (швидка зарядка їх мембранної ємності) фільтрують високі часові частоти, які складають постсинаптичні потенціали (ПСП), тим самим дозволяючи дендритам діяти, як фільтр низьких частот. Теорія переконливо довела, що навіть в пасивних дендритах віддалені синапси здатні суттєво впливати на вихідний імпульс аксона, сприяючи значній деполяризації соми.
В цілому, кабельна теорія, розроблена Роллом, продемонструвала, що комбінація специфічної морфології та електричних властивостей мембрани і цитоплазми (зокрема електротонічної структури) визначає обробку та поширення електричних сигналів в дендритах. Інакше кажучи, навіть два морфологічно ідентичні дендритні дерева, але з різними електричними властивостями, можуть мати зовсім різні обчислювальні характеристики.
Електричні та морфологічні властивості пасивних дендритів
В пасивному дендритному дереві вплив «збуджувального постсинаптичного потенціалу» (ЗПСП) на нейронний кінцевий вихідний сигнал залежить від його здатності деполяризувати аксон, що, в свою чергу, залежить від а) первинного розміру та форми синаптичної відповіді, і б) від того, наскільки кабельні властивості дендритного дерева фільтрують цю відповідь протягом її поширення від синапса до аксонного горбика.
Кабельна теорія та компартментне моделювання показали, що дендритна морфологія відіграє важливу роль у формуванні локальних синаптичних відповідей: віддалені вхідні імпульси мають значно більші амплітуди локальних реакцій, аніж подібні синаптичні сигнали в більш близьких до соми регіонах[17][58][59]. Причиною цього є те, що віддалені дендрити більш звужені (<1 мкм), аніж ближчі, а тому вони створюють значно більший локальний вхідний імпеданс і меншу локальну мембранну ємність, що веде до збільшення амплітуди та прискорення проходження локальних змін напруги[60]. З іншого боку, синаптичні відповіді, що виникають в дендритах, ближчих до соми, фільтруються існуючою тут великою локальною ємністю, що зменшує їх амплітуду та уповільнює їх часову ходу. В підсумку, швидкі синаптичні провідності у віддалених дендритних сегментах генерують більші та швидші локальні зміни напруги, аніж такі ж самі провідності у ближчих регіонах.
Просторово-часова сумація вхідних імпульсів
Незалежно від локалізації на дендритному дереві, в більшості нейронів єдина синаптична відповідь сама по собі не в змозі деполяризувати мембрану для генерації потенціалу дії. В більшості випадків генерація ПД потребує сумації множини ЗПСПів, взаємодія між якими обмежується тими самими пасивними властивостями дендритів, що й локальна амплітуда та поширення одиничних синаптичних відповідей. Кабельна теорія передбачає[17][53], що рівень сумації залежить від відносної ізоляції індивідуальних синаптичних провідностей: збуджувальні синапси, що знаходяться в безпосередній близькості і збігаються у часі, сумуються сублінійно через зменшення рушійної сили (різниця між мембранним потенціалом і потенціалом рівноваги іонів); тоді як просторово і часово розподілені синаптичні відповіді сумуються майже лінійно. Ці припущення згодом були підтверджені експериментально і лягли в основу розуміння того, як сигнали інтегруються в пасивних дендритах[61][62].
Просторова сумація описує взаємодію збіжних синаптичних вхідних сигналів і залежить від їх відносної локалізації на дендритному дереві. В пасивному дендриті максимальна (лінійна) сумація має місце тільки тоді, коли одночасно активовані синапси є настільки просторово віддаленими, що деполяризація, викликана одним синаптичним імпульсом суттєво не зменшує рушійної сили в іншому регіоні дендрита. З цього випливало, що одна з можливих функцій дендритних дерев полягає в просторовій ізоляції синаптичних вхідних сигналів для подальшого посилення їх сумації в місці генерування потенціалу дії. Ця ідея зберігає свою силу і сьогодні, оскільки в ряді досліджень було показано, що вхідні імпульси до нейронів є розподіленими вздовж дендритного дерева[62][63].
З іншого боку, тоді як збуджувальні близькі синапси, коли одночасно активуються, сумуються сублінійно, то синаптичні відповіді, які зміщені в часі і їх зміни провідності не перекриваються, сумуються лінійно. Важливим для просторово-часової сумації в дендритах є те, що, постсинаптичні потенціали зазвичай розпадаються з частотою, яка в кілька разів повільніша, аніж зміни провідностей, що лежать в основі швидкої синаптичної передачі сигналу[64], тож рівень і сила синаптичного взаємозв'язку не є сталими і залежать як від кінетики типів рецепторів в синапсі, так і від мембранних властивостей та морфології дендритного дерева.
В цілому, як випливає з кабельної теорії дендритів, наслідком взаємодії між дендритною морфологією та просторово-часовими формами синаптичної активації є асиметрична відповідь соми, що виникає в результаті послідовної активації синаптичних імпульсів в дендриті. Як Ролл вперше показав[64], послідовна активація збуджувальних синапсів на віддалених регіонах дендрита спричинить більшу мембранну деполяризацію, аніж подібна послідовна активація, яка б поширювалась від ближчих до віддалених регіонів. Це пояснює те, чому нейрони по-різному реагують на зміни в просторових формах послідовних синаптичних імпульсів.
Взаємодія збуджувальних та гальмівних синапсів
В кабельній теорії ті самі властивості, що визначають просторову та часову взаємодії збуджувальних відповідей, також контролюють взаємодію збуджувальних вхідних імпульсів із синаптичним гальмуванням. Нейромедіатором швидкого синаптичного гальмування в мозку ссавців є, головним чином, γ-аміномасляна кислота (ГАМК). ГАМК діє на ГАМКA-рецептор та зумовлює аніонну мембранну провідність із потенціалом реверсії близьким до потенціалу спокою. Тож ГАМК може призвести або до гіперполяризуючих, або до деполяризуючих відповідей в нейронах[65][66][67]. Спроможність ГАМК гальмувати генерацію потенціалу дії лежить в її здатності послаблювати збіжні ЗПСПи через «затискання» мембранного потенціалу нижче порогу потенціалу дії. Ролл та інші дослідники того часу передбачили, що цей вид шунтуючого інгібування повинен бути більш ефективним, аніж звичайна постсинаптична гіперполяризація[56][64].
Шунтуюче інгібування надає нейрону кілька важливих обчислювальних переваг. По-перше, оскільки ГАМКергічні вхідні імпульси є гальмівними лише протягом періоду їх зміни провідності, інгібування є дуже точним в часі, гальмуючи генерацію потенціалу дії тільки кілька мілісекунд, протягом яких ГАМКергічна провідність активна[68]. По-друге, оскільки зміни провідності значно більш просторово обмежені, аніж зумовлені ними зміни напруги, то шунтуюче інгібування забезпечує ефективне гальмування для даного регіону дендридтного дерева, при цьому надто суттєво впливаючи на збудливість в інших регіонах дендритів[69][70]. По-третє, індивідуальні деполяризуючі відповіді на ГАМК можуть (залежно від їх часу та місця відносно інших збуджувальних вхідних імпульсів) бути як гальмівними, так і збуджувальними[71][72].
Новим, що принесла кабельна теорія в розуміння синапсів, було те, що синаптичні імпульси є, скоріш, змінами провідності, аніж джерелами напруги, і що їх взаємодія суттєво обмежується дендритною морфологією.
Хоча сьогодні вже відомо, що дендрити не є пасивними та здатні активно впливати на проходження синаптичного потенціалу, кабельна теорія пасивних дендритів і понині використовується нейробіологами для вивчення біофізичних властивостей дендритів[15]. А дендрити деяких типів нейронів, навіть ті, які мають потенціал-залежні канали (інтернейрони мозочку[73], нейрони-восьминоги слухової системи[74], корзинчасті нейрони гіпокампа[75], гранулярних клітинах зубчастої звивини[76][77], нейрони грибоподібного тіла[78], пірамідні нейрони нюхової кори (pyriform cortex)[79]), характеризуються пасивними властивостями, аніж активною провідністю, а тому краще можуть бути пояснені з допомогою кабельної теорії[80].
Активна природа дендритів
Хоча вже в 1950-х роках було достатньо багато емпіричних даних, що свідчили на користь активної ролі дендритів в нейронних процесах (напр., відкриття розповсюдження потенціалу дії по дендритах пірамідних нейронів[81]), але вони все одно були в меншості у порівнянні із протилежними даними. Саме тому відкриття потенціал-залежних іонних каналів в дендритах[82][83][84] стало одним із найбільш переконливих свідчень того, що дендрити володіють активними властивостями у обробці вхідної інформації.
Існує суттєва різниця між пасивною і активною дендритною провідністю струму. У випадку, коли дендрити пасивні, а сома активна, то обробка дендритами збуджувальних постсинаптичних потенціалів (ЗПСП) є мінімальною: найбільше, що відбудеться із ЗПСП, коли він поширюється до соми, це зменшення в його амплітуді та збільшення в ширині, як результат міжмембранного витоку та фільтрування[64][85]. Інтеграція ЗПСПів в пасивних дендритах описується кількома простими правилами: потенціали, які виходять із місць, електротонічно віддалених один від одного, лінійно сумуються (в протилежному випадку ЗПСПи будуть сумуватись сублінійно через зменшення рушійної сили синаптичного струму та збільшення шунтування); коли ж вже об'єднаний ЗПСП, що досягає соми, є достатньо великим, виникає потенціал дії (ПД) в аксонному горбику. Далі, ПД проходить назад до соми та вперед по аксону, де він «передається» іншим нейронам. За такої моделі нейрону тривале подразнення веде до повторюваного розряду в нейроні з частотою, пропорційною величині синаптичного струму, який надходить до соми[86].
Однак, дані правила важко застосувати до нейрону, який володіє дендритами з активною провідністю струму, як показали останні дослідження[87]. Залежно від того, яка активується дендритна провідність, ЗПСПи можуть прискорюватись або затухати до досягнення соми; ЗПСПли можуть сумуватись лійнійно, сублінійно чи суперлінійно. Потенціал дії та інші регенеративні події можуть бути ініційовані навіть в дендритах, утворюючи різноманітну палітру спайкових форм: від повторюваних спалахів до пачок. Така докорінна відмінність пасивних дендритів від активних пов'язана з наявністю в останніх потенціал-залежних каналів, природа і розташування яких є ключовою для формування унікальної поведінки дендритів. Коли ці канали активуються, струми через них можуть змінювати амплітуду і часові характеристики синаптичного імпульсу, та навіть за певних умов генерувати «все-або-нічого» регенеративні потенціали. Відтак, синаптичний імпульс, який надходить до соми, буде дуже зміненою версією первинного імпульса[88].
Потенціал-залежні іонні канали в дендритах
Відкриття, з використанням мікроелектродів, існування в дендритах великих, короткочасних деполяризацій (спайків), приводило до думки, що дендрити повинні містити іонні канали. Ці канали повинні були б відкриватись у відповідь на мембранну деполяризацію і, в свою чергу, спричиняти подальшу мембранну деполяризацію, яка відповідальна за їх регенеративну природу. Подальше використання петч-клемп методів для вивчення дендритних властивостей в зрізах мозку дійсно підтвердило існування великого багатоманіття потенціалзалежних іонних каналів в дендритній мембрані[89]. Разом із даними, отриманими з допомогою перфорованого петч-клемпу, ці дослідження дозволили створити кількісні «карти» розподілу потенціалзалежних каналів в деяких типах нейронів. І хоча дендрити мають ті ж потенціалзалежні канали, що й аксон, щільність цих каналів в дендритній мембрані менша ніж 10 каналів на мікрометр квадратний, тоді як перехоплення Ранв'є в аксоні містить до 1000—2000 швидких натрієвих каналів[29].
Подібно до того, наскільки багато у ЦНС є різноманітних дендритних морфологій, так само багато є різних варіацій іонних каналів в дендритних деревах. І хоча існує суттєва різниця між дендритними каналами навіть в межах одного класу нейронів (напр., між кірковими і гіпокампними пірамідним нейронами), накопичені дані дозволяють виділити їх спільні риси та функції. Так, більшість дендритних дерев (крім клітин Пуркіньє) містять деякі з типів N+, K+ та Ca2+ іонних каналів, як і гіперполяризаційно активовані та внутрішньо-випрямляючі калієві канали[90][91]. Перевага потенціал-залежних іонних каналів в ЦНС полягає в тому, що їх фундаментальні властивості (різноманітні потенціальні залежності) і щільність можуть бути легко модульовані, що у випадку дендритів дозволяє їх нейронам докорінно змінювати спосіб, в який вони зберігають та обробляють інформацію, змінюючи саму обчислювальну природу нейрону[92].
Na+
Як і в аксонах, у дендритах також були виявлені Na+ канали, які відповідають за генерацію та розповсюдження потенціалу дії майже у всіх аксонах. У деяких нейронах (неокортикальних пірамідних нейронах, мітральних нейронах і CA1 пірамідних нейронах) щільність Na+ каналів є відносно високою і постійною по всьому дендритному дереві, що дозволяє їм впливати на проходження постсинаптичного потенціалу, прискорювати його[83][93][94]. Найбільша щільність Na+ в дендритах була виявлена в CA1 інтернейронах[95]. Однак в ін. типах нейронів (напр., гангліозних клітинах сітківки, дофамінергічних нейронах чорної субстанції, гранулярних клітинах тощо) ця щільність не є такою великою, що пояснює те, чому деякі з цих дендритів не можуть згенерувати потенціал дії[96].
Відносно однорідні властивості активації Na+ каналів породжують швидкий вхідний струм, що радикально збільшує збудження дендритів, дозволяючи їм генерувати і розповсюджувати потенціал дії так само, як і аксонам та підтримувати зворотне поширення аксонного потенціалу дії в дендритні дерева[97]. Дендритні Na+ канали мають ті самі біофізичні та фармакологічні властивості, як і інші нейронні TTX-уразливі канали[98]. Більшість (>80 %) цих каналів активуються в стані мембранного потенціалу спокою, а значна активація Na+ каналу починається, коли деполяризація досягає ~20 мВ. Ці канали мають швидку активаційну та інактиваційну кінетики і основоположну провідність окремого каналу в середньому = 15 пСм[99]. Ці канали, зазвичай, модулюються протеїнкіназами і G-білками, які здатні сильно впливати на потенціал-залежні властивості дендритів[100].
K+
Інший важливий тип іонних каналів, знайдених в дендритах, є K+ канали, які є головними регуляторами збудливості в нейронах[82]. Потенціалзалежні калєві (Kv) канали більш чи менш однорідно розподілені у віддалених дендритах порівняно з сомою. Винятком є канали підродини Kv4, які переважно локалізовані в дендритах[101] Kv4 субодиниці формують швидко активовані та інактивовані струми в гетерологічних системах експресії, що схожі на K+ струм А-типу (IA) в нейронах. фармакологічні, електрофізіологічні та імуногістохімічні дослідження показали, що K+ канали А-типу в деяких типів центральних нейронів є більш активними в апікальних, радіально нахилених та базальних дендритах, аніж в сомі[102][103]. Дендрити неокортикальних та CA1 пірамідних нейронів мають K+ іонні канали із властивостями, схожими до K+ каналів з затриманим випрямленням.
Короткочасні K+ канали типу А (KA) були знайдені в мозочкових клітинах Пуркіньє, де вони відповідають за ще більше посилення сильно згасаючих зворотно-протікаючих потенціалів дії[104]. Однією з найбільш щільних є присутність А-типу K+ каналів в пучкових та мітральних клітинах нюхової системи, як і в CA1 пірамідних нейронах. Тоді як в таламо-кортикальних нейронах та глибинних клітинах неокортексу KA канали розподілені менш щільно[105]. В цілому, ці дендритні калієві канали знижують дендритну збудливість; обмежують розповсюдження локальних дендритних спайків та Ca2+ сигналів, породжених синаптичними вхідними імпульсами або потенціалами дії зворотного поширення; задіяні в реполяризації фази потенціалу дії; обмежують амплітуду потенціалу дії зворотного поширення; збільшують поріг для генерації потенціалу дії в дендриті, а також контролюють частоту його спалахів[106]. Тому ці канали впливають на форми синаптичної пластичності, які залежать від потенціалів дії зворотного поширення чи локальних спайків.
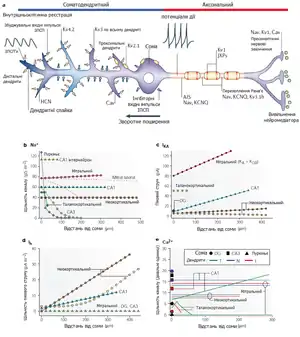
Дендрити і шипики кількох центральних нейронів також місять кальцій-активовані калієві (KCa) канали[107]. KCa2 (кальцій-активовані калієві канали малої провідності, або SK) канали локалізовані близько до синаптичних та екстрасинаптичних глутаматних рецепторів, тобто вони мають синаптичні функції[108]. Зокрема, ці канали зменшують дендритну інтеграцію через обмеження Ca2+ спайків (плато-потенціалів), викликаних сильним синаптичним вхідним імпульсом[107]. Також, в гіпокампі та мигдалині входження Ca2+ через NMDA-рецептори активує KCa2 канали, гіперполяризує мембрану та сприяє блокуванню NMDA-рецептора магнієм (Mg2+), обмежуючи подальшу активацію. Відтак, KCa2-опосередкований негативний зворотний зв'язок до NMDA-рецепторів впливає на стимуляцію хеббівської пластичності[109][110][111].
Іншою групою K+ каналів, які зокрема присутні в апікальних дендритах неокортикальних та гіпокампних CA1 нейронів, є калієві канали вхідного випрямлення (Kir)[112], тобто канали, які більш легко проводять струм у внутрішньому напрямку (всередину клітини), аніж в зовнішньому напрямку (з клітини). Ці канали характеризуються односпрямованим внутрішнім випрямленням, керованим внутрішньоклітинним катіонним блокуванням[113]. Відтак, при мембранних потенціалах більш негативних, аніж потенціал спокою, Kir канали проводять внутрішній струм, повертаючи мембрану до потенціалу спокою. Однак, при потенціалі, більш позитивному, аніж потенціал спокою, катіони запобігають гіперполяризації мембрани зовнішніми K+ струмами. Такі фундаментальні випрямляючі властивості Kir каналів є визначальними для підтримки мембранного потенціалу. Із семи підтипів Kir каналів, Kir3.x канали унікальні тим, що вони активуються G-білок пов'язаними рецепторами (G-protein coupled receptors (GPCR))[114].
HCN
Дендрити і шипики нейронів гіпокампа та кори мають особливо високу щільність HCN («гіперполяризаційно-активуючихся керованих циклічними нуклеотидами») каналів, зокрема HCN1 та HCN2 канали зосереджені переважно в дендритах. Найбільше HCN-каналів в CA1 нейронах гіпокампа, де їх щільність від соми до найближчих дендритів зростає у шість разів. Але особливо важливою є їх роль у функціонуванні клітин Пуркіньє, — де HCN-канали наявні як у сомі, так і в дендритах, — підтримуючи їх тонічні імпульси.
HCN-канали мають незвичні біофізичні властивості: вони проникні як для Na+, так і для K+; активуються гіперполяризацією (-50 мВ), а деактивуються деполяризацією[89][115]. Тож, ці канали активні в стані мембранного потенціалу спокою і контролюють його у більшості нейронів. Ih катіонний струм, який проходить через ці канали, сприяє генерації ритмічних імпульсів (зокрема в серці та неокортексі), знижує вхідний опір клітини, зменшує збудливість дендритів та регулює розмір і час протікання синаптичних потенціалів до соми[16][116]. Внаслідок зменшення вхідного опору (імпедансу), Ih послаблює глутаматергічні вхідні імпульси та прискорює загасання збуджувальних постсинаптичних потенціалів, що значно обмежує часову сумацію ЗПСП'ів та дендритну інтеграцію[117][118].
Подібно до інших активних провідників, HCN канали модулюються внутрішньоклітинними медіаторами. Блокування Ih зменшує поріг для генерації дендритних спайків пачками потенціалів дії зворотного поширення, тоді як підвищуюча регуляція Ih знижує збудливість дендритів CA1 пірамідних нейронів, зменшуючи можливість породження потенціалу дії синаптичними вхідними імпульсами[105][119].
Крім того, дендритні Ih можуть збільшувати точність виявлення коінциденцій (збігів) віддалених вхідних сигналів, а також діяти, як фільтр, що оптимізує апікальні дендрити для низькочастотних осцилюючих вхідних імпульсів[120][121]. Також ключову роль Ih відіграє в е синаптичній пластичності: NMDA-зумовлена LTP збільшує активність HCN каналів в CA1 нейронах гіпокампа, тоді як LTD її зменшує[122][123].
Ca2+
Одними з найважливіших для активних функцій дендритів є Ca2+ канали (VGCC, voltage-gated Ca2+ channels), які, подібно до Na+, здатні прискорювати ЗПСП'и[124]. Імуногістохімічні та електофізіологічні дослідження виявили існування всіх підтипів VGCC в дендритних стовбурах і ряд підтипів в дендритних шипиках багатьох нейронів[102][125].
Серед Ca2+ найпоширенішими є три типи потенціал-залежних каналів[126][127]:
- CaT (Cav3.x)(низькопорогові кальцієві канали, LVA) активність одного каналу яких, на відміну від інших типів Ca2+ каналів, має малу провідність (~9 пСм) та високу кальцієву проникність. Початок активації LVA каналів близький до потенціалу спокою (>-70 мВ), із відносно повільною активаційною (~5 мск при 0 мВ) та швидкою інактиваційною (~30 мск при -60мВ) кінетикою[128][129]. У порівнянні з іншими кальцієвими потенціалзалженими каналами, LVA канали мають унікально повільну кінетику деактивації (~4 мск при -60 мВ)[93]. Ці канали можуть бути активовані єдиним підпороговим ЗПСП, прискорювати ЗПСП і лежать в основі суперлінійної сумації ЗПСПів. LVA присутні в дендритах багатьох типів нейронів: клітинах Пуркіньє, пірамідних нейронах гіпокампа, таламокротикальних релейних нейронах, мітральних клітинах та гранулярних клітинах[84][130][131].
- CaL (Cav1.2 і Cav1.3) (вископорогові канали, HVA) найбільш локалізовані у близьких до соми дендритах (~25 пСм) і обумовлюють тривалий притік Ca2+. Це є струм, що відносно швидко активується (~1 мск при 0 мВ) та деактивуєтья і внаслідок відсутності потенціалзалежної інактивації є досить тривалим. Дві ізоформи HVA в ЦНС (Cav1.2 та Cav1.3) мають відмінні діапазони активації. Cav1.3 канали починають активацію в стані значно більш гіперполяризованих потенціалів (>-60 мВ) у порівнянні з Cav1.2 каналами (>-30 мВ)[132][133].
- CaN, CaP/Q та CaR (Cav2.1, Cav2.2. і Cav2.3) — високопорогові канали, найбільш однорідно розподілені на деяких шипиках по всьому дендритному дереві[134]. Ці HVA струми передаються швидко активуючимися (час досягнення піку ~1 мск при 0 мВ) каналами із одиничною провідністю ~15 пСм. Ці канали мають різний діапазон інактивації, де Cav2.3 мають більш швидку, а Cav2.1 більш повільну кінетику інактивації[135][136]. Діапазони напруги активації для цієї групи каналів є майже однорідними (Cav2.1 і Cav2.3 починають активуватись при >-40 мВ), хоча Cav2.2 канали мають відносно більш деполяризований діапазон активації (починають активуватись при >-20 мВ)[128][137].
Дендрити деяких нейронів, як кіркові 5 шару, CA1 пірамідні нейрони та нейрони в базальних гангліях, мають всі підтипи HVA каналів (L-, N-, P/Q-, та R-тип)[138]. Відносно повільний, більш тривалий внутрішній струм, який постачається Ca2+ каналами, ще більше додає до збудження дендритної мембрани та виконує ряд важливих ролей в дендритах: відкриття VGCC посилюється синаптичними потенціалами та зворотнім поширенням аксонного потенціалу дії, інколи призводячи до генерації Ca2+ спайків та плато-потецніалів[139][140]; локалізовані в дендритних шипиках кіркових пірамідних клітин, вони є основою підсилення синаптичних імпульсів[141]; інші сприяють генерації пачок потенціалів дії, дендритних спайків, а в мітральних клітинах та дофамінергічних нейронах обумовлюють кальцій-залежне вивільнення медіатора[142][143][144].
Оскільки внутрішньоклітинний кальцій може діяти як вторинний посередник, то потенціал-залежні канали в дендритах мають здатність з'єднувати електричні сигнали з внутрішньокілтинною біохімією. Тож, дендритні Ca2+ канали важливі не тільки для синаптичної інтеграції, але й синаптичної пластичності[145][146]. Потенціалзалежні Ca2+ канали модулюються G-білками, кіназами, фосфатами та ліпідними модуляторами
Відкриття потенціал-залежних іонних каналів із різною щільністю та біофізичними властивостями вздовж аксо-сома-дендритної осі вперше засвідчило, що не тільки сома, але й дендрити відіграють активну роль у формуванні нейронних збуджень. Оскільки провідність та розподіл потенціалзалежних каналів різниться серед різних типів нейронів та дендритних гілок (наприклад, апікальні від базальних дендритів), то інтеграція вхідних синаптичних імпульсів залежить не тільки від специфічних морфологічних та пасивних властивостей дендритного дерева, але й від експресії та кінетики активної провідності його іонних каналів[11][147].
| Іонні канали в дендритах[90] | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Потенціалзалежність | Потенціалзалежність | Кінетика | Кінетика | Кінетика | ||||||||
| Канали | Активація * | Інактивація ** | Активація | Деактивація | Інактивація | Фармакологія | Модулює | |||||
| Na+ | >-45 мВ | >80 % | <1 мс | <1 мс | -1 мс | TTX | PKC | |||||
| CaT | >-70 мВ | <25 % | 5 мс | 5 мс | 25 мс | Ni | ? | |||||
| CaL | >-60 мВ | ~100 % | ~1 мс | <1 мс | мінімальна | Дигідропіридин | PKA | |||||
| CaN | >-20 мВ | >70 % | ~1 мс | <1 мс | 50 мс | GVIA | G-білок | |||||
| CaP | >-40 мВ | >90 % | ~1 мс | <1 мс | 100 мс | Aga IVA | G-білок | |||||
| CaR | >-40 мВ | >50 % | ~1 мс | <1 мс | 50 мс | Ni | ? | |||||
| Kтранзієнт | >-50 мВ | >70 % | ~1 мс | <1 мс | ~7 мс | 4AP | Кінази | |||||
| KD | >-50 мВ | >70 % | ~1 мс | <1 мс | ~20 мс | αDTX | Кінази | |||||
| KS | >-30 мВ | ~100 % | ~3 мс | <1 мс | мінімальна | TEA | Кінази | |||||
| H | <-50 мв | ~100 % | ~50 мс | 5 мс | жодної | ZD-7288 | CNT | |||||
- Потенціали при яких канали починають активуватись
- Відсоток популяції каналів, доступних при -70 мВ
Дендритний потенціал дії
Хоча потенціал дії генерується переважно на низькопороговому початковому сегменті аксона (AIS), існує багато даних на користь того, що спайки також можуть генеруватись в дендритах (звідси інколи і відмінність у назвах: «потенціал дії аксону» і «дендритний спайк»).
Завдяки наявності різних потенціалзалежних каналів з різною кінетикою, дендрити володіють різноманітним репертуаром активних властивостей, включаючи активне зворотне поширення аксонного потенціалу дії в дендритне дерево. Генерування в дендритах спайків найчастіше пов'язане із активною провідністю Ca2+ чи Na+ каналів, або їх обох[94][148]. Крім того, дендритні спайки також породжуються завдяки NMDA (N-метил-D-аспартат) каналам, які активуються глутамат нейромедіаторами[87][149].
Оскільки локальний поріг для генерації цих дендритних спайків є значно вищим, аніж для потенціалу дії в аксоні, то їх виникнення зазвичай вимагає відносно сильної синхронної синаптичної активації і тому може поставати, як форма детектора коінциденцій (збігів)[150]. Відтак, зворотне поширення потенціалів дії та дендритні Ca2+ і Na+ спайки повинні генеруватись різними формами та механізмами синаптичної активності.
Породжені в дендритах спайки не є однорідними в способі, швидкості та ефективності їх поширення до соми. В деяких нейронах дендритні спайки успішно поширюються в бік соми, майже не зменшуючись в амплітуді[95][96][151]. В інших нейронах дендритні спайки можуть залишатись ізольованими в дендритах[152][153][154].
Наявність такого різноманіття дендритних спайків і їх варіабельності в різних нейронах дозволяє дендритам не тільки активно впливати на те, як нейрони інтегрують та обробляють вхідні синаптичні імпульси, але й на нейронну синаптичну пластичність, навчання та пам'ять[155].
Модуляція синаптичних імпульсів
З часу відкриття перших іонних каналів постало питання, навіщо на дендритах стільки багато різних провідних структур, якщо їх вплив не відчутний на аксонному потенціалі дії? Однією з найбільш поширених ідей щодо функцій потенціал-залежних (внутрішній струм) каналів в дендритах є та, що вони підсилюють віддалені синаптичні імпульси. Хоча В. Ролл довів, що ґрунтуючись на суто пасивних властивостях, віддалені ЗПСПи не убувають до нуля в сомі, як спочатку вважалось, вони тим не менше суттєво зменшаться в амплітуді. Відтак, Na+ і Ca+ канали, відкриті завдяки ЗПСПм, протистоятимуть пасивному убуванню імпульсу через модуляцію чи підсилення величини ЗПСПів.
Багато каналів в дендритах можуть бути активовані підпороговими ЗПСПми. Застосування методів кальцієвої візуалізації[84] та петч-клемп з прикріпленою клітиною[93] показало, що викликані стимуляцією складні ЗПСПи можуть породити в дендритах деполяризацію, достатню для відкриття Na+ та низько-порогових Ca2+ каналів. В дендритах існує декілька каналів, на які можуть впливати підпорогові ЗПСПи: INaP, ICaT, Ih та ін. Коли ці канали активуються, струм через них може змінити форму ЗПСПів: активація каналів, що генерують внутрішній струм (INaP і ICaT), посилить амплітуду ЗПСПів, тоді як активація каналів, що генерують зовнішні струми (як IА), послабить ЗПСПи. З іншого боку, деактивація каналів, що вже є активними в стані спокою (як Ih), збільшить нейронний вхідний опір і тому збільшить амплітуду ЗПСП. В реальності ЗПСП змінює стани активації кількох каналів одночасно. Загальний вплив на форму ЗПСПів залежать від балансу між каналами, що генерують внутрішні та зовнішні струми[156].
Підсилення збуджуючих постсинаптичних потенціалів
Натрієві та кальцієві канали, локалізовані в шипиках та інших віддалених дендритних відростках, в поєднанні із NMDA-рецепторами, забезпечують унікальний механізм підсилення вхідних локальних синаптичних імпульсів. В типовому дендритному дереві, вхідні імпеданси на віддалених гілках та шипиках зростають у порівнянні з їх низьким значенням ближче до соми. Відтак, віддалені збуджувальні синаптичні вхідні імпульси зустрічають більш сприятливі умови для породження локальних регенеративних потенціалів та значно більше підсилюються завдяки локальним збуджуючим потенціалзалежним каналам, у порівнянні із синапсами на більш близьких до соми дендритах.
Результати кількох експериментів із CA1 пірамідними клітинами гіпокампа чітко показали, що дендритні INaP і ICaT канали здатні посилювати ЗПСПи по дорозі до соми[157]. В цих дослідах петч-клемп реєстрація цілої клітини була зроблена на сомі, а ЗПСПи були викликані через стимуляцію аферентних волокон на віддалених апікальних дендритах. Фокальне прикладення антагоністів до найближчих сегментів апікальних дендритів зменшило амплітуду ЗПСП, залежно від блокаторів, на 27 % і 33 %. Тоді як застосування антагоністів до соми мало незначний вплив на амплітуду ЗПСП, тим самим підтверджуючи, що дендритні INaP і ICaT активно збільшили ЗПСП. Більше того, моделювання INaP каналів показало, що їх локальна щільність та просторова розподіленість розширюють часовий хід підсилених ЗПСПів, тобто ці канали можуть збільшувати ймовірність генерації потенціалу дії[158].
INaT та високопорогові Ca2+ канали також здатні посилювати ЗПСПи. Власне найбільш разючі приклади посилення сигналів спостерігаються, коли викликані стимуляцією ЗПСПи запускають в дендритах Na+-опосередковані потенціали дії, Ca2+-опосередковані регенеративні потенціали або плато-потенціали[153]. Хоча, слід зазначити, існують і протилежні експериментальні дані, котрі не так однозначно вказують на важливу роль даного посилення для проходження ЗПСПів, як і те, чи воно відбувається завдяки дендритним чи соматичним струмам[159][160].
Детектор збігів
Існування дендритних потенціалзалежних каналів та NMDA-спайку є важливими механізмами для міждендритних взаємодій в безпосередній близькості синаптичних входів. Потенціалзалежні канали можуть змінювати локальний вхідний опір та часову сталу, що в свою чергу суттєво вплине на просторову та часову сумацію ЗПСП та ГПСП[161]. Взаємодія синапсів також може бути надзвичайно нелінійною: зустріч багатьох ЗПСПів на одній і ті й же дендритній гілці в межах вузького часового інтервалу може активувати потенціалзалежні канали та породити значно більшу відповідь, аніж якби вони були на різних гілках чи трапились поза цим часовим інтервалом[162]. Такий сценарій можливої взаємодії синаптичних потенціалів в дендритах привів нейробіологів до думки, що дендрити із активними властивостями є детекторами збігів (coincidence detectors)[163] (див. також критичні зауваги[164] та відповідь на них[165]), тобто вони мають здатність «відчувати» одночасне надходження синаптичних вхідних імпульсів в різних точках того самого нейрона. Традиційно, виявлення коінциденцій(збігів) означало лише збіг активації достатньо великої кількості вхідних імпульсів для досягнення порогу генерації потенціалу дії. Втім, дендрити, як активні механізми, вводять нові форми виявлення збігів: збіг спайків в багатьох дендритних гілках або збіг активації багатьох дендритних регіонів.
Одним з таких детекторів збігів може бути NMDA-рецептор. Через його проникність для кальцію, і через те, що його блокатор у потенціалі спокою Mg2+ може бути розблокований постсинаптичною деполяризацією, NMDA рецептор розглядається як ідеальний кандидат для виявлення збігів між пре- та постсинаптичною активністю і для переведення її в постсинаптичну кальцієву концентрацію[166][167]. Відтак, постсинаптично локалізовані NMDA рецептори можуть виявити збіг у вивільненні глутамату внаслідок пресинаптичної активності та деполяризацію внаслідок постинаптичних спайків. Результатом цього є суперлінійний ріст концентрації Ca2+, у порівнянні із самою лише пре- або постсинаптичною активністю. Свідчення такого виявлення збігів на основі NMDA-рецептора були виявлені в гіпокампі[168] та неокортексі[169]. Подібне дендритне виявлення збігів було виявлене і для потенціалзалежних каналів. У віддалених синапсах на апікальних дендритах пірамідних нейронів 5-го шару, об'єднання постсинаптичного потенціалу дії та синаптичного вхідного імпульсу може викликати вельми нелінійне підсилення дендритних потенціалів дії зворотного поширення завдяки залученню потенціалзалежних Na+ каналів[103].
Хоча гіпотеза дендритів, як детектора збігів, є темою палких дебатів між вченими, існування такого механізму має ряд експериментальних підтверджень. До прикладу, в CA1 пірамідних нейронах, синапси апікального пучка не проявляють синаптичного масштабування і тому, ймовірно, впливають на потенціал дії або через сумування із синаптичними вхідними імпульсами від колатералей Шафера (в'язка волокон, яка йде від поля CA3 до поля CA1 гіпокампу), або через генерацію дендритних спайків[170]. Як показали експерименти та симуляції, віддалені дендритні спайки надійно не поширюються від апікального пучка до головного апікального дендрита[154]. Ця неспроможність поширення дендритного спайку пов'язана із значним падінням вхідного імпеданса в точках, де малі гілки з'єднані із великими дендритами. Коли ж колатераль Шаффера та перфорантний шлях (perforant path) активуються разом, дендритні спайки можуть поширюватись надійно до соми. І навпаки, інгібування, націлене на апікальний дендрит, унеможливлює поширення дендритного спайка[171]. Отож, синаптичний вхідний імпульс до апікального дендрита може відкрити або закрити «ворота», що регулюють вплив віддалено генерованих дендритних спайків на початок аксонного потенціалу дії.
Один з найбільш яскравих експериментальних прикладів, що свідчить на користь існування дендритного детектора збігів, був виявлений в пірамідних нейронах 5-го шару: збуджувальні синаптичні вхідні імпульси на віддаленому апікальному пучку, збігаючись із потенціалом дії зворотного поширення, генерують довгий (10 мс і більше) Ca+ спайк (BAC firing), який, в свою чергу, поширюється в бік соми і спонукає аксон породити пачкові (burst) натрієві потенціали дії. Натрієвий потенціал дії зворотного поширення слугує як «зв'язуючий» механізм для специфічної комбінації вхідних імпульсів в дендритному дереві[12][172]. Цей механізм дозволяє виявити збіг активацій синаптичних вхідних імпульсів до двох головних сегментів дендритного дерева і, відтак, може бути залучений у одночасну активність (синхронізацію) в різних шарах кори.
| Дендритний детектор збігів | |
|---|---|
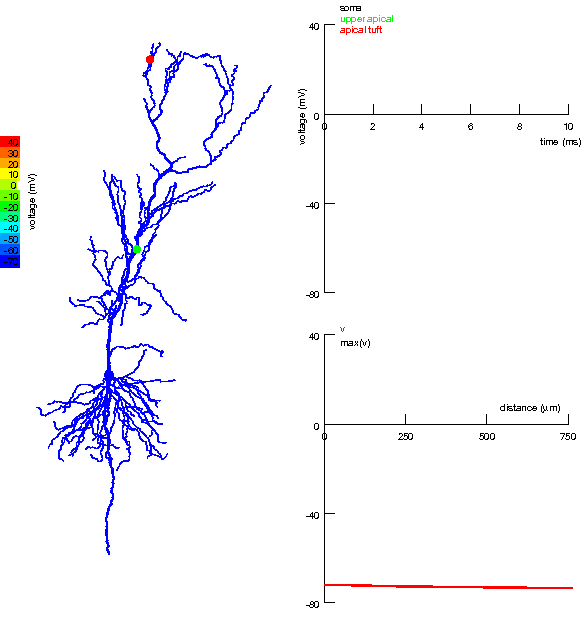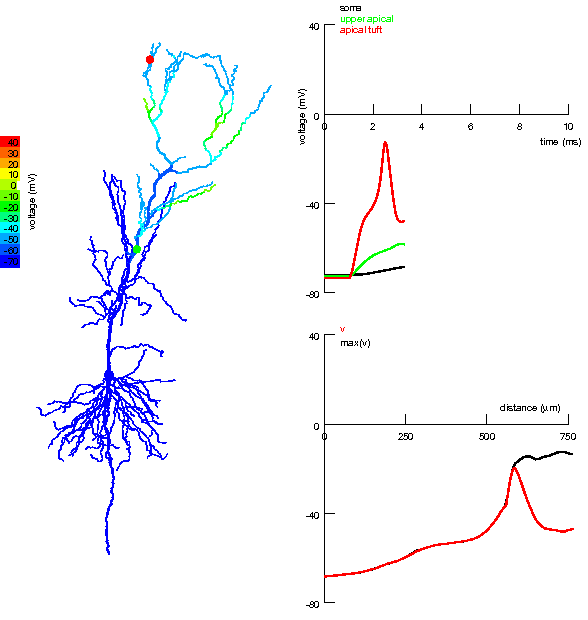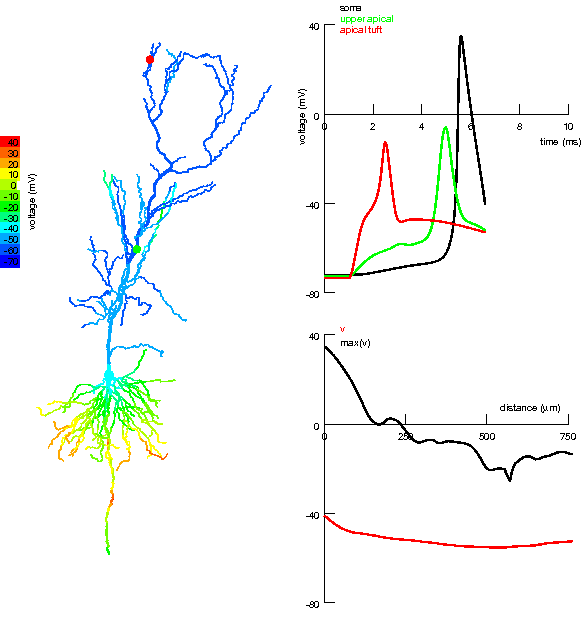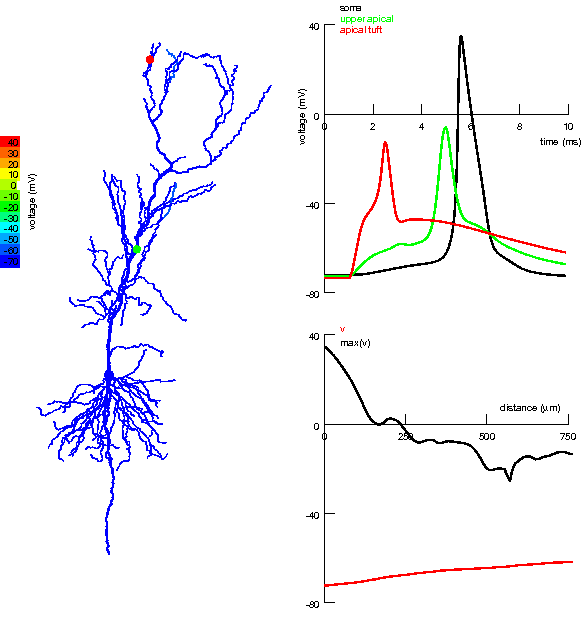 |
Анімована симуляція детектора збігів в апікальних та нахилених дендритах пірамідного нейрону гіпокампа. Ліворуч: Кольорове подання надходження окремих збуджувальних вхідних імпульсів до апікального пучка і близьких регіонів апікальних дендритів та генерація потенціалу дії після збігу. Вхідний імпульс до ближчих від соми дендритів слабший, але він сприяє поширенню дендритного спайка, який виник в результаті сильного вхідного імпульсу до апікального пучка (зверху). Праворуч:
Дендритні спайки були викликані сильним збуджувальним імпульсом перфорантного шляху, але їх поширення до соми було підсилене збуджувальними імпульсами колатералі Шаффера. За відсутності останнього, дендритний спайк з апікального пучка не в змозі досягти соми і не генерує потенціалу дії. Однак, навіть незначні імпульси колатералі здатні настільки підсилити просування цих дендритних спайків до соми, що ті навіть можуть генерувати потенціал дії в аксоні та сомі.[171] |
«Дендритна демократія»
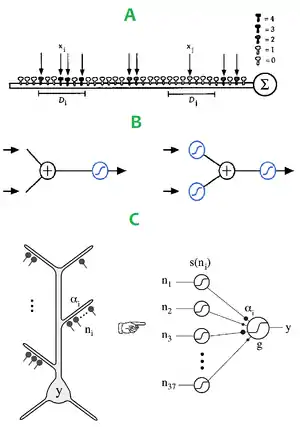
Кабельна структура дендритного дерева, як випливає з кабельної теорії та експериментальних даних, призводить до загасання синаптичного потенціалу. Зокрема, довгі тонкі дендрити, які мають великий осьовий опір, суттєво послаблюють потенціал в підпороговій фазі[175]. До прикладу, загасання пікової амплітуди ЗПСПів в ході їх поширення від місця виникнення до соми може бути більш ніж стократним для найбільш віддалених синапсів в кіркових L5 пірамідних нейронах[85]. Частково це пов'язано із низькочастотною фільтрацією, що проявляється швидкими стрибками напруги в дендритах, і що також може призвести до суттєвих уповільнень електричної провідності[176]. Через таке загасання дендритної напруги, синапси в різних точках дендритів не є рівно ефективними у їх впливі на аксонний потенціал дії. Цей факт породив поняття «дендритної демократії»[177][178], тобто, в якій ступені всі синаптичні вхідні імпульси будь-якого нейронного типу можуть бути однаково «почуті» і майже миттєво разом оброблені сомою.
Загасання заряду в довгих та тонких дендритах пірамідних клітин суттєво зменшує соматичну амплітуду ЗПСПів, які виникають в синапсах у віддалених дендритів, у порівнянні з ЗПСПми, що виникають в ближчих синапсах з тією самою синаптичною провідністю, тим самим роблячи ці нейрони скоріш «дендритно не-демократичними»[177]. Але зовсім інша ситуація із клітинами Пуркіньє, чиї шипикові гілочки є відносно короткими і безпосередньо сполучені із товстішими головними дендритами. Відтак, рівна синаптична провідність на віддалених та близьких шипикових гілках клітини Пуркіньє зумовлює дуже схожі соматичні амплітуди ЗПСПів[179]. Це, також, черговий приклад впливу морфології дендритів на їх провідність та цілісну нейронну поведінку: дендритна геометрія клітин Пуркіньє по своїй природі є більш «демократична», аніж, наприклад, пірамідних клітин. «Дефіцит демократії» пірамідних клітин частково компенсується пов'язаним з відстанню масштабуванням синаптичної провідності в апікальних дендритах CA1 нейронів[60].
Проте цей тип компенсуючого синаптичного масштабування не був знайдений в базальних та апікальних дендритах нейронів 5 шару кори[180][181]. Одне з рішень цієї ключової для розуміння активної природи дендритів проблеми полягає в тому, що «не цілком демократичні» дендрити неокортикальних пірамідних нейронів, — в силу складності інформації, яку вони оброблять, — складаються із відносно незалежних обчислювальних субодинць, які сигмоїдально модулюють їх синаптичні вхідні імпульси до глобального сумування і кожна з яких здатна породжувати дендритний спайк. Чи приведуть ці спайки до аксонного потенціалу дії залежатиме від інтеграції одиничних відповідей цих субодиниць[182].
Один з можливих компромісів між «демократією» і «незалежністю» в дендритній обробці інформації нещодавно був знайдений при вивченні не пірамідних клітин, а т. зв. координатних (grid) клітин (зірчастих нейронів енторіальної кори)[183] і полягає в тому, що якщо дендрити мають сильний вплив на соматичний мембранний потенціал («демократія»), тоді, через двосторонність електротонічного з'єднання (існування градієнту напруги між дендритами і сомою, як результат потенціалу дії зворотного поширення), сома сильніше впливатиме на дендритні процеси (втрата «незалежності» — здатності самостійно від інших дендритів інтегрувати свої вхідні сигнали), вироджуючи їх локально сумовану інформацію. Інакше кажучи, збільшення дендритної незалежності веде до зменшення їх впливу на сому і, як наслідок, до зменшення синаптичних вхідних сигналів на самі дендрити.
Дендритні спайки можуть бути породжені кластерними або розподіленими вхідними імпульсами до однієї дендритної гілки. Однак вхідні імпульси, розподілені на багатьох дендритних гілках будуть менш ефективні, тож вони, скоріш за все, повинні групуватись в кластери[184][185][186]. За таким сценарієм сусідні вхідні імпульси на тій самій гілці сумуються сигмоїдально, тоді як надто віддалені вхідні імпульси або імпульси до різних гілок сумуються лінійно. Подібна просторова сегментація обробки імпульсів у дендритах не підтримує ідею про глобальну сумацію і, натомість, дозволяє говорити про пірамідний нейрон, як двошарову «нейронну мережу», де дендрити постають, як «нейрони в нейронах»: на першому шарі синаптичні вхідні імпульси інтегруються індивідуальними гілками, сигмоїдальними субодиницями (що відповідає довгим, тонким дендритам клітини), а на другому шарі вихідні імпульси цих субодиниць сумуються в головному дендритному пучку і сомі, перш ніж досягнути конечного порогу генерації потенціалу дії[174][187][188].
Ця ідея також може бути розширена: пірамідний нейрон розглядається, яка багатошарова мережа, де інтеграція окремо відбувається в апікальному пучку, апікальному нахиленні, а базальні дендритні гілки діють як проміжні шари[189]. Ці ідеї нещодавно знайшли ряд експериментальних підтверджень[190][191][192]. Див. приклад з CA1 пірамідними нейронами в попередньому розділі. Так само було відкрито, що поширення дендритних спайків підтримується синаптично активністю на задньому тлі в пірамідних нейронах 5-го шару[181].
Втім, двошарова модель нейрону описує тільки просторове групування синаптичних вхідних імпульсів, залишаючи поза увагою, як нейрон обробляє часові форми вхідних імпульсів. Наразі запропонована тільки одна компартментна модель, яка здатна пояснити часову інтеграцію імпульсів дендритами. Відповідно до цієї моделі, відповідь дендритних сегментів може бути описана як нелінійна сигмоїдальна функція одночасно і ступеня часової синхронності, і просторового групування синаптичних входів. Тоді нейрон постає як багатошарова мережа: дендрити вибірково підсилюють відповіді до релевантних просторово-часових вхідних спайків, тим самим діючи в різних інтегративних режимах як багатошаровий детектор збігів[193]. Ця модель також узгоджується із експериментальними даними, які показують, що в різних поведінкових станах можуть бути залучені різні форми нейронної інтеграції[194].
Кластеризація і недемократичність згаданих нейронів обумовлена складною морфологією їх дендритів, існуванням активних струмів та локальних спайків, які по-різному впливають на інтеграцію ПСП. Значно більш демократичними є нейрони, дендрити яких мають пасивні кабельні властивості, як до прикладу, CA3 пірамідні і не-пірамідні нейрони, інтернейрони мозочка, чи гранулярні клітини зубчастої звивини. Моделювання та in vivo дослідження пасивних дендритів засвідчують, що синаптичний імпульс до проксимального дендрита викличе соматичний ПСП, який тільки на 10-12 % більший, від ПСП, викликаного синапсом на найбільш віддаленому дендриті[73][76][77].
Тобто, для пасивних дендритів, на відміну від активних, положення синапса не має значного впливу на соматичний ПСП і всі синапси мають рівний «голос» в сомі. Механізмом такої демократизації є т. зв. «пасивна синаптична нормалізація» вхідних імпульсів, яка трансформує локальні високоамплітудні ПСП'и, — які широко розсіюються по клітині, але мають обмежений діапазон, — в низькоамплітудні коливання мембранного потенціалу близько до соми[15].
Дендрити, як обчислювальні субодиниці нейронів
Відомий постулат Дональда Хебба, який є основою класичної теорії синаптичної пластичності, трактує всі синапси рівними та ігнорує будь-який внесок дендритів в синаптичну пластичність. Як він писав у своєму підручнику з психології: «…[Ф]ункцією дендритів є отримання збуджень від інших клітин… Дендритна провідність є повільною та неефективною, вважається, що вони є примітивними структурами, а безпосереднє збудження тіла клітини є еволюційне удосконалення, яке дозволяє більш ефективну провідність»[195]. Подібно до Хебба, інші нейробіологи довгий час також вважали, що дендрити виконують лише з'єднувальну функцію і тільки передають інформацію від синапсів до соми, не відіграючи якої-небудь значної ролі в синаптичній пластичності, зміні вхідних імпульсів і обчисленнях нейрону.
Докорінна зміна в уявленні про природу та функції дендритів була пов'язана з теоретичними працями Вілфріда Ролла та його учнів і колег, які показали, що навіть пасивні дендрити мають значний вплив на електричні властивості соми. Втім, з обчислювальної точки зору, пасивні дендрити можуть виконувати лише кілька елементарних операцій: фільтр низьких частот, арифметику з насиченням і схожі на множення взаємодії між синаптичними вхідними імпульсами[196]. Однак значно багатший та складніший репертуар нелінійних і нестаціонарних операцій з'являється, якщо дендритні дерева мають потенціал-залежні мембранні провідності.
Окрім вже зазначених інтегративних властивостей, активні дендрити володіють складним і поки що мало зрозумілим апаратом для синаптичної пластичності[197]. За останні кілька десятиліть було знайдено цілий масив свідчень дендритної пластичності, як то синаптична (гомо- і гетеросинаптична) та внутрішня пластичність і гомеостатичні механізми, що часто діють локально і паралельно один з одним, регулюючи активні властивості дендритів, тим самим впливаючи не тільки на дендритні обчислення, але й на формування пам'яті та навчання на субклітинному рівні[198][199][200][201].
Окрім того, завдяки складній морфології та існуванню чисельних потенціал-залежних іонних каналів, дендрити перетворюють одиничні нейрони на потужні фунцкіональні обчислювальні мікросхеми, які здатні виконувати операції, що раніше вважались можливими лише для популяції нейронних мереж. Зокрема, протягом останніх двох десятиліть було відкрито, що дендрити спроможні виконувати синхронізацію та класифікацію вхідних синаптичних сигналів[192][202], виявляти напрямок руху (напрямкова вибірковість) в зоровій системі[203][204], паралельно обчислювати різні потоки інформації[205], локалізувати джерело звуку в слухові системі[206], а дендритні шипики навіть можуть бути налаштовані на різні частоти та інтенсивність тонів[207].
Всі ці обчислювальні властивості дендритів роблять навіть індивідуальний нейрон здатним до активної обробки складної інформації та її зберігання, тим самим вирішуючи ряд класичних проблем в нейробіології, які довгий час не могли бути вирішені, оскільки більшість підходів до них ґрунтувалось головним чином на точковій моделі нейрону, без урахування активної ролі дендритів[205].
Патологія дендритів
Одним із найбільш переконливих свідчень щодо активної і важливої ролі дендритів у нейронних процесах є нейродегенративні, вікові та психіатричні розлади, які з ними пов'язані. Із збільшенням даних про інтегративні та пластичні функції дендритів, також збільшується розуміння, чому навіть невеликі структурні зміни в дендритах здатні призвести до (чи супроводжувати) значних порушень у нормальному функціонуванні мозку.
1974 року Домінік Пурпура (Dominick Purpura) у своїй вже класичній статті в Science[208] висунув гіпотезу, що відкриті в ті часи аномалії дендритних шипиків (дисгенез) лежать в основі деяких із типів розумової відсталості. Ця стаття, разом з іншими[209][210], започаткувала детальне вивчення дендритів та шипиків і їх зв'язку з психоневрологічними захворюваннями. З тих пір було відкрито сильну кореляцію між дендритною патологією та розумовою відсталістю, зокрема такими захворюваннями, як аутизм, синдроми Дауна, Ретта, Мартіна-Белл, Вільямса та Рубінштейна-Тейбі[211][212].
В цілому, ці та інші вікові розлади характеризуються зменшенням дендритної довжини, скороченням форм розгалужень та кількості шипиків. Ті ж шипики, що залишаються, часто є дуже довгими та тонкими[214]. Зрозуміло, що виконуючи важливі біологічні та обчислювальні функції, так кардинально змінені дендрити не можуть функціонувати нормально. Разом з тим, змінена морфологія може й не бути первинною причиною розладів, натомість виступати, як компенсаційна або вторинна зміна, пов'язана з іншою, більш первинною патологією. До прикладу, багато із зазначених змін дендритної морфології можуть виникати внаслідок деаферентації (втрати можливості проведення сенсорного збудження від периферії до центру)[215].
Перші свідчення про зміни в морфології дендритів, зумовлених патологічними порушеннями, були отримані при дослідженні уражень викликаних деаферентацією і, як наслідок, втратою синаптичних вхідних імпульсів. Було виявлено, що ці ураження привели до цілковитого зменшення, деформації та дезорієнтації дендритів в мозочкових клітинах Пуркіньє[216]. Зумовлені ураженнями дендритні зміни (суттєве скорочення довжини віддалених дендритів) також були виявлені в гранулярних клітинах в зубчатій звивині як наслідок деаферентації енторіальної кори. З іншого боку, був виявлений і зворотній ефект — розпускання базальних дендритів гранулярних клітин гіпокампа, спричинене тривалою епілептиформною активністю[217].
Досить давно відомо, що втрата нейронів та синапсів в певних регіонах мозку є одним із наслідків нормального старіння в здорових дорослих. Окрім того, в процесі старіння було виявлено також зміни в дендритній структурі та кількості шипиків[218], хоча ступінь та специфіка цих змін наразі не відомі. Тож сьогодні ще важко пов'язувати ці морфологічні зміни із когнітивними порушеннями.
Окрім того, ряд досліджень показало, що значні зміни в морфології дендритів, шипиків та синапсів характерні для хвороби Альцгеймера[219][220][221] та шизофренії[222][223]. Бета-амілоїдний пептид, який може вести до утворення амілоїдних бляшок і пов'язаний із хворобою Альцегймера, може блокувати А-тип потенціал-залежного калієвого каналу в дендритах пірамідних клітин. Особливо вразливі до руйнівного впливу бета-амілоїдів калієві канали тонких гілок нахилених дендритів, в результаті чого можуть виникати погіршення когнітивних функцій[224].
Накопичення особливих протеїнів (т. зв. тільця Леві) в дендритах часто характерне для хвороби Паркінсона[225]. Однак наразі важко говорити про функціональні наслідки таких змін та про ступінь їх зв'язку із даними захворюваннями.
Методи дослідження та моделювання
| Дата | Методи і технології | Результати |
|---|---|---|
| 1870 | Метод Гольджі | Дендритна морфологія |
| 1930-ті | Зовнішньоклітинні поля | повільні хвилі кори |
| 1950-ті | Внутрішньоклітинна реєстрація | ЗПСП; за окремими винятками, пасивні дендрити |
| 1959 | Кабельна теорія | Дендрити впливають на електричні властивості соми |
| 1960-ті | Кількісна мікроанатомія | Дендритні параметри і виміри |
| 1970-ті | Міждендритна реєстрація | Дендритні потенціали дії |
| 1980-ті | Компартментне моделювання | Активні і пасивні властивості |
| 1980-ті | Молекулярна біологія | Молекулярне різноманіття каналів |
| 1990-ті | Флуоресцентна мікроскопія | [Ca2+]i входження в дендритах, шипиках[136] |
| 1990-ті | Петч-клемп дендритів[227] | Активність та інтегративність каналів |
| 1997 | Дво-фотонна мікроскопія | Реєстрація одиничного дендрита, кальцієві імпульси та детектор збігів |
| 1999 | Потенціал-залежні барвники | Одночасна реєстрація соми і дендрита, аксонний ПД, дендритний спайк і bAP |
| 2006 | Вивільнення глутамату (glutamate uncaging)[228] | Дендритна пластичність[185] |
| 2002-07 | Динамічний клемп (dynamic clamp)[229] | Дворівнева структура, дендритна демократія і дендритні обчислення |
| 2010-2013 | Моносинаптичне відслідковування з використання вірусних векторів; GCaMP[230] | Кластеризація шипиків; Візуалізація дендритного потенціалу дії, LTP та напрямкова вибірковість[231] |
Історія
Перший детальний опис дендритів (або «протоплазматичних відростків», як вони спочатку називались) був зроблений Камілло Гольджі в 1873 році. Втім він не зрозумів їх функції, вважаючи, що вони виконують лише живильну роль для нейрона. Першим, хто почав трактувати дендрити, як самостійні функціональні одиниці, був Сантьяго Рамон-і-Кахаль, який, використавши розроблений Гольджі метод фарбування нервових тканин, запропонував нейронну доктрину, згідно з якою дендрити поставали як місце синаптичних контактів між нейронами та виконували функцію приймання і передачі синаптичних імпульсів. Коли функції та типи дендритних дерев були вивчені більш детально, Вільям Гіс у 1889 році замінив термін «протоплазматичні відростки» на «дендрити».
Пізніше Рамон-і-Кахаль для пояснення механізмів нейронної обробки інформації запропонував концепцію «динамічної поляризації», згідно з якою інформація протікає в одному напрямку: синапс ⇢ дендрит ⇢ сома ⇢ аксон. Гіпотеза, яка лежала в основі такого припущення, полягала в тому, що для виконання інтегративних функцій нейроном, в ньому має відбуватись поступова сумація гальмівних та збуджувальних імпульсів, інакше нейрони та дендрити функціонуватимуть лише як реле, не змінюючи та не додаючи інформацію в процесі її передачі.
До 1930-х років вивчення дендритів було головним чином анатомічним і лише коли методи дослідження аксонів (отримані на основі вивчення периферійних нервів) були застосовані до вивчення електричних сигналів в корі головного мозку, дендрити почали вивчатись електрофізіологічно. Стимулювання зорового нерва або поверхні кори вело до появи від'ємного потенціалу (кілька мілівольт) на поверхні, що був надто повільним, аби бути наслідком аксонних потенціалів дії, що реєструвались в ізольованих периферійних нервах[232]. Тоді Джордж Бішоп (George H. Bishop) з колегами[233][234], використовуючи великі електроди для реєстрації в дендритних шарах зорової кори, зробили припущення, що ці від'ємні хвилі поверхні кори є непровідними, постійними потенціалами, які згодом Екклс трактував, як синаптичні потенціали в дендритах. Ґрунтуючись на цих здогадах та власних дослідженнях, Бішоп прийшов до висновку, що «головна і найбільш характерна функція нервових та інших збуджувальних тканин здійснюється за допомогою поступових реакцій»[235]. Оскільки таке уявлення електротонічного поширення реакцій в дендритах узгоджувалось з ідеями динамічної поляризації Кахаля та нейронної інтеграції Чарлза Шеррінгтона, то воно було найбільш поширеним (за окремими винятками[236]) серед нейробіологів аж до початку 1960-х років.
З появою внутрішньоклітинної реєстрації з допомогою мікроелектродів, в багатьох типах нейронів були відкриті збуджувальні та гальмівні постсинаптичні потенціали (ЗПСП та ГПСП). Також були визначені властивості синапсів (потенціал рівноваги) та виміряні ключові параметри постсинаптичної клітини (мембранні часова та просторова сталі). Накопичена нова інформація дозволила поставити ряд питань щодо того, як здійснюється інтеграція пасивних синаптичних потенціалів в дендритах, їх просторова і часова сумація. Було висунуто кілька припущень[235][237], що дендрити мають більш примітивну мембрану, аніж аксони, і тому не мають можливості для активної електричної провідності. Відповідно, вважалось (на основі досліджень мотонейронів[238] та сенсорних рецепторів[239], що потенціал дії виникає тільки в аксонному горбику, як наслідок алгебраїчної сумації ЗПСП та ГПСП, що надходять до різних частин нейрону.
Оскільки ґрунтовані на тодішніх електрофізіолгічних даних розрахунки для мотонейронів показали, що просторова стала (λ) є відносно малою, то ряд дослідників, особливо Джон Екклс, вважали, що ЗПСПи із синапсів у віддалених регіонах дендритів не мають значного впливу на електричну поведінку нейронів та генерацію потенціалу дії з огляду на швидке зниження їхньої амплітуди[238][240]; тільки синапси на ближчих до соми дендритах могли брати участь у нейронній активності.
Тому для багатьох нейробіологів стала великою несподіванкою опублікована в 1957 році стаття маловідомого Вілфріда Ролла (1922 р.н.), колишнього постдока Екклса, після якої з'явилась серія інших його статей, які змінили не тільки уявлення про дендрити, але й про нейрони[241]. Після відмінного навчання на фізичному факультеті Єльського університету, з початком війни він був залучений до аналітичної роботи в Мангеттенському проекті. Після війни, працюючи як постдок в Чиказькому університеті, Ролл отримав навички в електрофізіології та брав участь в експериментах з аксоном кальмара, які проводив відомий американський біофізик Кеннет Коул, і які в результаті призвели до відкриття потенціла дії. З початку 1950-х рр. він продовжив свої дослідження в лабораторії Екклса в Новій Зеландії, де вивчав з його групою передачу сигналів в мотонейронах, та використання мікроелектродів для реєстрації цих сигналів. Попрацювавши деякий час в лабораторії Бернарда Каца в Лондоні, він повернувся до США, де розпочав роботу в математичному відділенні Національних інститутів здоров'я.
В 1957 році Екклс та інші дослідники опублікували результати досліджень мотонейронів, які показували поширення потенціалів, викликаних інжекцією струму в тіло клітини. Фази розпаду потенціалів, вважав Екклс, виражаються лише однією експонентою, так, як у простій схемі опору та ємності, якими моделюється мембрана соми. Проаналізувавши дані Екклса та його групи, Ролл виявив, що реєстровані ними короткотривалі потенціали були значно повільнішими, аніж очікувалось, і скоріше за все це пов'язано з тим, що струм йде в дендрити, а отже часова і просторова сталі нейронів є значно більшими. Того ж 1957 року він опублікував коротку замітку в Science, де показав, що фіксовані Екклсом короткотривалі потенціали більше узгоджуються із моделлю соми, до якої приєднаний довгий циліндр, яким є дендритне дерево[242].
Коли Ролл усвідомив, що дендрити відіграють значну роль в електричній провідності нейронів, він почав детальне вивчення геометрії розгалужень дендритів мотонейронів, що дозволило йому застосувати до них кабельну теорію, звівши все різноманіття дендритних дерев до одного циліндра. Це не тільки спрощувало вивчення дендритів, але й дозволяло відкрити їх нові властивості: зокрема, Ролл передбачив, що синапси на віддалених дендритах також впливають на соматичну деполяризацію. Однак всі статті, які він надсилав до журналів, відхилялись редакторами, з аргументацією, що знайдене Роллом зниження короткотривалого потенціалу було пов'язане з особливостями технічних приладів і не мало суттєвого значення. Втім, на кількох статтях Ролл побачив коментарі та редагування, характер яких цілком свідчив, що їх читав Екклс. Тоді Ролл опублікував свої теоретичні статті у новому, маловідомому журналі «Experimental Neurology», в якому Екклс не був рецензентом[242][243].
Тільки через десятиліття, коли накопичилось нові дані, теорії Ролла отримали підтвердження та визнання, а його кабельні рівняння та математичні моделі дендритів заклали основу нової галузі нейронаук — обчислювальної нейронауки (computational neuroscience). Його подальші наукові роботи були черговим яскравим прикладом того, як в біології можуть ефективно поєднуватись математика та експеримент, а теорія може мати не менш важливе значення, аніж практика. Багато з проблем у вивченні дендритів, які потім сформувались у окремі теми, були так чи інакше підняті, передбачені чи вирішені Роллом. Тож, «історія кабельної теорії та дендритів є багато в чому історія однієї людини — Вілфріда Ролла»[244].
Втім, для того, аби обчислювальні моделі могли пояснити дендритні властивості, бракувало даних щодо їх детальної анатомії та фізіології. Саме тому в 1970-х роках нову сторінку у вивченні дендритів започаткувала кількісна мікроанатомія, тобто детальне і точне вимірювання дендритних діаметрів та довжини гілок. Завдяки кропіткій праці анатомів, фізіологів та математиків були отримані перші детальні параметри кіркових нейронів[245], мотонейронів[246], клітин Пуркіньє тощо[247][248]. Завдяки появі обчислювальної техніки та більш-менш гнучких мов програмування, отримані мікроанатомічні дані лягли в основу обчислювальних моделей, на основі яких було відкрито цілий ряд нових дендритних властивостей[249].
Хоча в 1950-х та ранніх 1960-х панівним було уявлення, що дендрити є пасивними відростками нейронів, які просто інтегрують збуджувальні та гальмівні імпульси, накопичувались поодинокі свідчення, що в дендритах також може поширюватись потенціал дії. Вперше його зафіксував у 1951 році видатний китайський нейрофізіолог Hsiang-Tung Chang, який тоді працював в Єльському університеті і мав ще більш драматичну долю, аніж Ролл[243]. В опублікованій того року статті він повідомив про те, що дендрити можуть збуджуватись під впливом електричної стимуляції і здатні генерувати потенціали дії, які відрізняються від аксонних тим, що не є «все-або-нічого» потенціалами[236]. У наступних восьми своїх публікаціях він підтвердив свої знахідки і навіть висунув радикальний здогад, що синапси на дендритах, на відміну від соми, пов'язані із свідомістю, сприйняттям та мисленням.
Іншим важливим здогадом Чанга було визнання за дендритними шипиками (які він називав «брунечки») функції обмеження синаптичної збудливості, оскільки вони постають як механічний бар'єр, що запобігає досяганню синаптичними виступами стовбура дендритів[250]. Шипики, через їх високий омічий опір, пов'язаний з їх надто тонкими «стеблами», повинні уповільнювати та послаблювати синаптичні збуджувальні імпульси, тим самим відіграючи активну, а не пасивну роль в синаптичній інтеграції[251]. Саме на основі цих результатів Чанга в 1970-х роках виникла нова цікавість до шипиків та їх ролі в навчанні та запам'ятовуванні.
Також в 1950-х роках ряд дослідників повідомляв про реєстрацію антидромічних потенціалів дії та дендритних спайків[252][253][254][255][256], що повинно було б схилити більше нейробіологів до визнання активної ролі дендритів. Втім, лише з кінця 1980-х — початку 1990-х вчені почали поступово схилятись до думки, що дендрити не тільки передають інформацію, але й змінюють та зберігають. Найбільш однозначно існування дендритних спайків було показано в серії статей Грега Стюарта та Берта Закмана протягом 1993—1998 років[83][96][152], які використали ціло-клітинні петч-електроди для реєстрації одночасно соматичного потенціалу дії та дендритного спайка. Це були перші безпосередні свідчення існування потенціалзалежних іонних каналів в дендритах, що слугують для генерації та підтримки потенціалів дії.
1990-ті та 2000-ні роки справедливо можуть бути названими періодом розквіту досліджень дендритів. Стрімкий прогрес технологій, молекулярної біології та обчислювальних технік призвів до швидкої появи нових відкриттів, пов'язаних з дендритними обчисленнями та пластичністю, як структурною, так і функціональною.
Див. також
Примітки
- 1) ↑ Дендритне поле — це весь регіон, який покривається дендритом даного нейрона і в якому дендрит отримує сенсорні або синаптичні вхідні імпульси.
- 2) ↑ Дана величина вимірюється в сантиметрах і означає, що відстань, на яку поширюється зміна потенціалу, має зростати із збільшенням опору мембрани (який перешкоджає втраті струму внаслідок витоку струму) і, навпаки, має зменшуватись із збільшенням внутрішнього опору (що перешкоджає проходженню струму вздовж волокна). Відтак, чим більше значення rm, тим більше значення , а чим більше значення , тим менше значення (див. детальніше Кабельна теорія дендритів).
- 3) ↑ Самопідтримуюча подія (імпульс), включаючи зворотний зв'язок, напр., між напругою та струмом, або кальцієм та напругою тощо.
- 4) ↑ Все-або-нічого — потенціал, який будучи генерований (після досягнення порогу збудження) розповсюджується сам по собі до завершення.
- 5) ↑ Цікаво, що «зворотне поширення» (англ. backpropagation) було запропоноване в теорії штучних нейронних мереж, ще до його відкриття в нейронах, як один з методів нейронного навчання. Див. метод зворотного поширення помилки. Подібно до навчання перцептрона, біологічне зворотне поширення також сприяє навчанню, посилюючи чи послаблюючи синаптичну пластичність. Однак, на відміну від перцептрона, зворотне поширення потенціалу дії відбувається в межах одного нейрона і завдяки існуванню дендритних локальних спайків може бути цілком незалежним від пост- і пресинаптичних нейронів, наділяючи один нейрон властивостями цілої нейронної мережі.
Джерела
- Fiala, J.C.; Harris, K. M (1999). Dendrite Structure. У Stuart G, Spruston N, Hausser M. Dendrites. Oxford University Press. с. 2–41. ISBN ISBN 0198566565.
- Kernell D. and Zwaagstra B. (1 червня 1989). Dendrites of cat's spinal motoneurones: relationship between stem diameter and predicted input conductance. The Journal of Physiology 413: 255–269. PMID 2600850.[недоступне посилання з серпня 2019]
- Squire, Larry, ред. (2008). Fundamental Neuroscience (вид. 3). с. 63. ISBN 978-0-12-374019-9.
- Kreitzer AC and Regehr WG. (1 червня 2002). Retrograde signaling by endocannabinoids. Current Opinion in Neurobiology 12 (3): 324–330. doi:10.1016/S0959-4388(02)00328-8.
- Spruston Nelson (2008). Pyramidal neurons: dendritic structure and synaptic integration. Nature Reviews Neuroscience 9 (3): 206–221. ISSN 1471-003X. doi:10.1038/nrn2286.
- Segev, Idan (1998). Cable and Compartmental Models of Dendritic Trees. The Book of GENESIS. Exploring Realistic Neural Models with the GEneral NEural SImulation System. Springer New York. с. 51–77. ISBN 978-1-4612-1634-6.
- García-López Pablo, García-Marín, Virginia and Freire, Miguel (October 2007). The discovery of dendritic spines by Cajal in 1888 and its relevance in the present neuroscience. Progress in Neurobiology 83 (2): 110–130. doi:10.1016/j.pneurobio.2007.06.002.
- Sholl, Donald Arthur (1956). The Organization of the Cerebral Cortex. Hafner Publishing Company. с. 125.
- Yang CR and Seamans JK (1 березня 1996). Dopamine D1 receptor actions in layers V-VI rat prefrontal cortex neurons in vitro: modulation of dendritic-somatic signal integration. The Journal of Neuroscience 16: 1922–1935.
- Graham Lyle J., van Elburg Ronald A. J., van Ooyen Arjen (2010). Impact of Dendritic Size and Dendritic Topology on Burst Firing in Pyramidal Cells. PLoS Computational Biology 6 (5): e1000781. ISSN 1553-7358. doi:10.1371/journal.pcbi.1000781.
- Vetter P., Roth A., and Häusser M. (1 лютого 2001). Propagation of Action Potentials in Dendrites Depends on Dendritic Morphology. Journal of neurophysiology 85: 926–937.
- Schaefer A. T., Larkum ME , Sakmann B , and Roth A (2003). Coincidence Detection in Pyramidal Neurons Is Tuned by Their Dendritic Branching Pattern. Journal of Neurophysiology 89 (6): 3143–3154. ISSN 0022-3077. doi:10.1152/jn.00046.2003.
- Byrne John H., Roberts James L., ред. (2009). From Molecules to Networks: An Introduction to Cellular and Molecular Neuroscience. Academic Press. с. 656. ISBN 9780080920832.
- London Michael, Schreibman Adi, Häusser Michael, Larkum Matthew E. and Segev Idan (2002). The information efficacy of a synapse. Nature Neuroscience 5 (4): 332–340. ISSN 10976256. doi:10.1038/nn826.
- Jaffe David B. and Carnevale Nicholas T. (1 грудня 1999). Passive Normalization of Synaptic Integration Influenced by Dendritic Architecture. Journal of neurophysiology 82: 3268–3285.
- Komendantov A. O. and Ascoli G. A. (2009). Dendritic Excitability and Neuronal Morphology as Determinants of Synaptic Efficacy. Journal of Neurophysiology 101 (4): 1847–1866. ISSN 0022-3077. doi:10.1152/jn.01235.2007.
- Rinzel John and Rall Wilfrid (October 1974). Transient Response in a Dendritic Neuron Model for Current Injected at One Branch. Biophysical Journal 14 (10): 759–790. doi:10.1016/S0006-3495(74)85948-5.
- Koch Christof and Zador Anthony (1 лютого 1993). The Function of Dendritic Spines: Devices Subserving Biochemical Rather Than Electrical Compartmentalization. The Journal of Neuroscience 13 (2): 413–422. PMID 8426220.
- Schüz Almut and Palm Günther (1989). Density of neurons and synapses in the cerebral cortex of the mouse. The Journal of Comparative Neurology 286 (4): 442–455. ISSN 0021-9967. doi:10.1002/cne.902860404.
- Braitenberg V. and Schüz A. (1998). Cortex: statistics and geometry of neuronal connectivity, 2nd ed. Springer. с. 249. ISBN 9783540638162.
- Braitenberg Valentino (2001). Brain Size and Number of Neurons: An Exercise in Synthetic Neuroanatomy. Journal of Computational Neuroscience 10 (1): 71–77. ISSN 09295313. doi:10.1023/A:1008920127052.
- Braitenberg, Valentino (1978). Cell Assemblies in the Cerebral Cortex. У Heim, Roland. Theoretical Approaches to Complex Systems: proceedings, Tübingen, June 11-12, 1977 21. Springer. с. 171–188. ISBN 978-3-642-93083-6.
- Braitenberg V. (1978). Cell Assemblies in the Cerebral Cortex 21. с. 171–188. ISSN 0341-633X. doi:10.1007/978-3-642-93083-6_9.
- Braitenberg Valentino (1974). Thoughts on the cerebral cortex. Journal of Theoretical Biology 46 (2): 421–447. ISSN 00225193. doi:10.1016/0022-5193(74)90007-1.
- Mainen, Z.F. and Sejnowski, T.J. (25 липня 1996). Influence of dendritic structure on firing pattern in model neocortical neurons. Nature 382: 363–366. PMID 8684467. doi:10.1038/382363a0.
- van Ooyen A, Duijnhouwer J, Remme MW, and van Pelt J. (Aug, 2002). The effect of dendritic topology on firing patterns in model neurons.. Network 13 (3): 311–25. PMID 12222816.
- Bastian, J. and Nguyenkim, J. (1 січня 2001). Dendritic modulation of burst-like firing in sensory neurons. Journal of Neurophysiology 85 (1): 10–22. PMID 11152701.
- Segev, Idan; London, Michael (2003). Dendritic Processing. Handbook Of Brain Theory And Neural Networks. Mit Press. с. 324–332. ISBN 9780262011976.
- Koch, Christof (2004). Biophysics of Computation: Information Processing in Single Neurons. Oxford University Press. с. 562. ISBN 9780195181999.
- Hammond, Constance (2001). Cellular and Molecular Neurobiology. Academic Press. с. 493. ISBN 9780080545967.
- Peters, Alan and Palay, Sanford L. (January 1996). The morphology of synapses. Journal of Neurocytology 25 (1): 687–700. doi:10.1007/BF02284835.
- Schmitt RO, Dev P, Smith BH. (1976 July 9). Electrotonic processing of information by brain cells.. Science: 114–120. PMID 180598.
- Fischer M., Kaech S., Knutti D., and Matus A. (May 1998). Rapid Actin-Based Plasticity in Dendritic Spines. Neuron 20 (5): 847–854. doi:10.1016/S0896-6273(00)80467-5.
- Chklovskii D. (2 вересня 2004). Synaptic Connectivity and Neuronal Morphology. Neuron 43: 609–617. doi:10.1016/j.neuron.2004.08.012. Текст « issue 5 » проігноровано (довідка)
- Harris, K.M. and Kater S.B. (March 1994). Dendritic Spines: Cellular Specializations Imparting Both Stability and Flexibility to Synaptic Function. Annual Review of Neuroscience 17: 341–371. doi:10.1146/annurev.ne.17.030194.002013.
- Segev, I., and Rall, W. (1 серпня 1988). Computational study of an excitable dendritic spine. Journal of Neurophysiology 60 (2): 499–523. PMID 2459320.
- Stepanyants Armen , Hof Patrick R. , Chklovskii Dmitri B. (11 квітня 2002). Geometry and Structural Plasticity of Synaptic Connectivity. Neuron 34 (2): 275–288. doi:10.1016/S0896-6273(02)00652-9.
- Yuste, Rafael (2010). Dendritic Spines. MIT Press. с. 264. ISBN 9780262013505.
- Holmes, William R.; Rall, Wilfrid (2003). Dendritic Spines. У Arbib, Michael. Handbook Of Brain Theory And Neural Networks. Mit Press. с. 332-335. ISBN 9780262011976.
- Holtmaat A, Wilbrecht L, Knott GW, Welker E, Svoboda K. (2006 Jun 22). Experience-dependent and cell-type-specific spine growth in the neocortex.. Nature 7096 (441): 979–983. doi:10.1038/nature04783.
- Kasai, H., Matsuzaki, M., Noguchi, J., Yasumatsu, N. & Nakahara, H. (July 2003). Structure–stability–function relationships of dendritic spines. Trends in Neurosciences 26 (7): 360–368. doi:10.1016/S0166-2236(03)00162-0.
- Matsuzaki, M., Honkura, N., Ellis-Davies, G. C. & Kasai, H. (17 червня 2004). Structural basis of long-term potentiation in single dendritic spines. Nature 429: 761–766. doi:10.1038/nature02617.
- Knott Graham and Holtmaat Anthony (2008). Dendritic spine plasticity—Current understanding from in vivo studies. Brain Research Reviews 58 (2): 282–289. ISSN 01650173. doi:10.1016/j.brainresrev.2008.01.002.
- Priel Avner, Tuszynski Jack A., and Woolf Nancy J. (2009). Neural cytoskeleton capabilities for learning and memory. Journal of Biological Physics 36 (1): 3–21. ISSN 0092-0606. doi:10.1007/s10867-009-9153-0.
- Yuste Rafael and Bonhoeffer Tobias (2001). Morphological changes in dendritic spines associated with long-term synaptic plasticity. Annual Review of Neuroscience 24 (1): 1071–1089. ISSN 0147-006X. doi:10.1146/annurev.neuro.24.1.1071.
- Hotulainen P. and Hoogenraad C. C. (2010). Actin in dendritic spines: connecting dynamics to function. The Journal of Cell Biology 189 (4): 619–629. ISSN 0021-9525. doi:10.1083/jcb.201003008.
- Buzsáki György, Anastassiou Costas A., and Koch Christof (2012). The origin of extracellular fields and currents — EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience 13 (6): 407–420. ISSN 1471-003X. doi:10.1038/nrn3241.
- Einevoll Gaute T., Kayser Christoph, Logothetis Nikos K., and Panzeri Stefano (2013). Modelling and analysis of local field potentials for studying the function of cortical circuits. Nature Reviews Neuroscience 14 (11): 770–785. ISSN 1471-003X. doi:10.1038/nrn3599.
- McCulloch, Warren S. and Pitts, Walter (December 1943). A logical calculus of the ideas immanent in nervous activity. The bulletin of mathematical biophysics 5 (4): 115–133. doi:10.1007/BF02478259.
- Rall Wilfrid (March 1962a). Theory of physiological properties of dendrites. Annals of the New York Academy of Sciences 96: 1071–1092. doi:10.1111/j.1749-6632.1962.tb54120.x.
- Rall Wilfrid (March 1962b). Electrophysiology of a dendritic neuron model. Biophysical Journal 2: 145–167.
- Rall Wilfrid (November 1959). Branching dendritic trees and motoneuron membrane resistivity. Experimental Neurology 1 (5): 491–527. doi:10.1016/0014-4886(59)90046-9.
- Rall Wilfrid and Rinzel John (July 1973). Branch Input Resistance and Steady Attenuation for Input to One Branch of a Dendritic Neuron Model. Biophysical journal 13: 648–688. doi:10.1016/S0006-3495(73)86014-X.
- Rall Wilfrid (December 1969,). Time constants and electrotonic length of membrane cylinders and neurons. Biophysical Journal 9: 1483–1508. doi:10.1016/S0006-3495(69)86467-2.
- Segev Idan (November 1992). Single Neuron Models: Oversimple, Complex and Reduced. Trends In Neurosciences 15: 414–421. doi:10.1016/0166-2236(92)90003-Q.
- Coombs J. S. ,Eccles J. C. , and Fatt P. (1955 November 2). Excitatory synaptic action in motoneurones. The Journal of physiology 130: 374–395.
- Segev I., Rinzel J. and Shepherd G., ред. (1995). The Theoretical Foundation of Dendritic Function: Selected Papers of Wilfrid Rall with Commentaries. MIT Press. с. 456. ISBN 9780262193566.
- Chitwood Raymond A., Hubbard Aida, and Jaffe David B. (1999). Passive electrotonic properties of rat hippocampal CA3 interneurones. The Journal of Physiology 515 (3): 743–756. ISSN 0022-3751. doi:10.1111/j.1469-7793.1999.743ab.x.
- Segev I. and London M. (2000). Untangling Dendrites with Quantitative Models. Science 290 (5492): 744–750. ISSN 00368075. doi:10.1126/science.290.5492.744.
- Williams S. R. and Stuart Greg J. (2002). Dependence of EPSP Efficacy on Synapse Location in Neocortical Pyramidal Neurons. Science 295 (5561): 1907–1910. ISSN 00368075. doi:10.1126/science.1067903.
- Cash Sydney and Yuste Rafael (1999). Linear Summation of Excitatory Inputs by CA1 Pyramidal Neurons. Neuron 22 (2): 383–394. ISSN 08966273. doi:10.1016/S0896-6273(00)81098-3.
- Lörincz Andrea, Notomi Takuya, Tamás Gábor, Shigemoto Ryuichi, and Nusser Zoltan (2002). Polarized and compartment-dependent distribution of HCN1 in pyramidal cell dendrites. Nature Neuroscience 5 (11): 1185–1193. ISSN 10976256. doi:10.1038/nn962.
- Markram Henry, Lübke Joachim , Frotscher Michael and Sakmann Bert (1997). Regulation of Synaptic Efficacy by Coincidence of Postsynaptic APs and EPSPs. Science 275 (5297): 213–215. ISSN 00368075. doi:10.1126/science.275.5297.213.
- Rall, Wilfrid (1964.). Theoretical significance of dendritic trees for neuronal input-output relations.. Neural Theory and Modeling: Proceedings of the 1962 Ojai Symposium. Stanford University Press. с. 73–97. ISBN 9780804701945.
- Owens David F. and Kriegstein Arnold R. (2002). Is there more to gaba than synaptic inhibition?. Nature Reviews Neuroscience 3 (9): 715–727. ISSN 1471003X. doi:10.1038/nrn919.
- Marty Alain and Llano Isabel (2005). Excitatory effects of GABA in established brain networks. Trends in Neurosciences 28 (6): 284–289. ISSN 01662236. doi:10.1016/j.tins.2005.04.003.
- Gulledge Allan T. and Stuart Greg J. (2003). Excitatory Actions of GABA in the Cortex. Neuron 37 (2): 299–309. ISSN 08966273. doi:10.1016/S0896-6273(02)01146-7.
- Staley K. J. and Mody I. (1 липня 1992). Shunting of excitatory input to dentate gyrus granule cells by a depolarizing GABAA receptor-mediated postsynaptic conductance. The Journal of Neurophysiology 68: 197–212.
- Jack James , Noble Denis , Tsien Richard W. (1975). Electric Current Flow in Excitable Cells. Oxford University Press. с. 518.
- Zador A., Koch C., and Brown T.H. (1 вересня 1990). Biophysical model of a Hebbian synapse. PNAS 87: 6718–6722.
- Segev I. and Parnas I. (1983). Synaptic integration mechanisms. Theoretical and experimental investigation of temporal postsynaptic interactions between excitatory and inhibitory inputs. Biophysical Journal 41 (1): 41–50. ISSN 00063495. doi:10.1016/S0006-3495(83)84404-X.
- Bar-Ilan Lital, Gidon Albert, and Segev Idan (2013). The role of dendritic inhibition in shaping the plasticity of excitatory synapses. Frontiers in Neural Circuits 6. ISSN 1662-5110. doi:10.3389/fncir.2012.00118.
- Abrahamsson Therese, Cathala Laurence, Matsui Ko, Shigemoto Ryuichi, and DiGregorio David A. (2012). Thin Dendrites of Cerebellar Interneurons Confer Sublinear Synaptic Integration and a Gradient of Short-Term Plasticity. Neuron 73 (6): 1159–1172. ISSN 08966273. doi:10.1016/j.neuron.2012.01.027.
- McGinley M. J., Liberman M. C., Bal R., & Oertel D. (2012). Generating Synchrony from the Asynchronous: Compensation for Cochlear Traveling Wave Delays by the Dendrites of Individual Brainstem Neurons. Journal of Neuroscience 32 (27): 9301–9311. ISSN 0270-6474. doi:10.1523/JNEUROSCI.0272-12.2012.
- Norenberg A., Hu H., Vida I., Bartos M., and Jonas P. (2009). Distinct nonuniform cable properties optimize rapid and efficient activation of fast-spiking GABAergic interneurons. Proceedings of the National Academy of Sciences 107 (2): 894–899. ISSN 0027-8424. doi:10.1073/pnas.0910716107.
- Schmidt-Hieber C., Jonas P., Bischofberger J. (2007). Subthreshold Dendritic Signal Processing and Coincidence Detection in Dentate Gyrus Granule Cells. Journal of Neuroscience 27 (31): 8430–8441. ISSN 0270-6474. doi:10.1523/JNEUROSCI.1787-07.2007.
- Krueppel Roland, Remy Stefan, and Beck Heinz (2011). Dendritic Integration in Hippocampal Dentate Granule Cells. Neuron 71 (3): 512–528. ISSN 08966273. doi:10.1016/j.neuron.2011.05.043.
- Gruntman Eyal and Turner Glenn C (2013). Integration of the olfactory code across dendritic claws of single mushroom body neurons. Nature Neuroscience. ISSN 1097-6256. doi:10.1038/nn.3547.
- Bathellier B., Margrie T. W., and Larkum M. E. (2009). Properties of Piriform Cortex Pyramidal Cell Dendrites: Implications for Olfactory Circuit Design. Journal of Neuroscience 29 (40): 12641–12652. ISSN 0270-6474. doi:10.1523/JNEUROSCI.1124-09.2009.
- Cazé Romain Daniel, Humphries Mark, & Gutkin Boris (2013). Passive Dendrites Enable Single Neurons to Compute Linearly Non-separable Functions. PLoS computational biology 9 (2): e1002867. doi:10.1371/journal.pcbi.1002867.
- Li CL. and Jasper H. (1953 July 28). Microelectrode studies of the electrical activity of the cerebral cortex in the cat. The Journal of physiology 121: 117–140.
- Hoffman DA , Magee JC , Colbert CM , Johnston D (26 червня 1997). K+ channel regulation of signal propagation in dendrites of hippocampal pyramidal neurons. Nature 387: 869 – 875.
- Stuart Greg J.and Sakmann Bert (1994). Active propagation of somatic action potentials into neocortical pyramidal cell dendrites. Nature 367 (6458): 69–72. ISSN 0028-0836. doi:10.1038/367069a0.
- Markram H. and Sakmann B. (24 травня 1994). Calcium transients in dendrites of neocortical neurons evoked by single subthreshold excitatory postsynaptic potentials via low-voltage-activated calcium channels. PNAS 91: 5207–5211.
- Stuart G and Spruston N. (1998 May 15). Determinants of voltage attenuation in neocortical pyramidal neuron dendrites.. The Journal of Neuroscience 18: 3501–10. PMID 9570781.
- Powers RK, Robinson FR, Konodi MA, Binder MD (1 вересня 1992). Effective synaptic current can be estimated from measurements of neuronal discharge. Journal of Neurophysiology 68: 964–68. PMID 1432061.
- Major Guy, Larkum Matthew E. and Schiller Jackie (2013). Active Properties of Neocortical Pyramidal Neuron Dendrites. Annual Review of Neuroscience 36 (1): 1–24. ISSN 0147-006X. doi:10.1146/annurev-neuro-062111-150343.
- Migliore Michele and Shepherd Gordon M. (2002). Emerging rules for the distributions of active dendritic conductances. Nature Reviews Neuroscience 3 (5): 362–370. ISSN 1471-003X. doi:10.1038/nrn810.
- Hille, Bertil (2001). Ionic Channels of Excitable Membranes. Sinauer Associates, Incorporated. с. 814. ISBN 9780878933211.
- Magee, JC (1999). Voltage-gated ion channels in dendrites. У Stuart G, Spruston N, Hausser M. Dendrites. Oxford University Press. с. 139–160. ISBN ISBN 0198566565.
- Lai Helen C. and Jan Lily Y. (2006). The distribution and targeting of neuronal voltage-gated ion channels. Nature Reviews Neuroscience 7 (7): 548–562. ISSN 1471-003X. doi:10.1038/nrn1938.
- Larkum Matthew and Nevian Thomas (2008). Synaptic clustering by dendritic signalling mechanisms. Current Opinion in Neurobiology 18 (3): 321–331. ISSN 09594388. doi:10.1016/j.conb.2008.08.013.
- Magee J C and Johnston D (15 серпня 1995). Characterization of single voltage-gated Na+ and Ca2+ channels in apical dendrites of rat CA1 pyramidal neurons.. The Journal of Physiology 487: 67–90. Архів оригіналу за липня 4, 2012. Процитовано жовтня 6, 2013.
- Xiong Wenhui and Chen Wei R. (2002). Dynamic Gating of Spike Propagation in the Mitral Cell Lateral Dendrites. Neuron 34 (1): 115–126. ISSN 08966273. doi:10.1016/S0896-6273(02)00628-1.
- Martina M., Vida Imre and Peter Jonas (2000). Distal Initiation and Active Propagation of Action Potentials in Interneuron Dendrites. Science 287 (5451): 295–300. ISSN 00368075. doi:10.1126/science.287.5451.295.
- Hausser Michael, Stuart Greg, Racca Claudia and Sakmann Bert (1995). Axonal initiation and active dendritic propagation of action potentials in substantia nigra neurons. Neuron 15 (3): 637–647. ISSN 08966273. doi:10.1016/0896-6273(95)90152-3.
- Magee Jeffrey C and Johnston Daniel (2005). Plasticity of dendritic function. Current Opinion in Neurobiology 15 (3): 334–342. ISSN 09594388. doi:10.1016/j.conb.2005.05.013.
- Marban Eduardo, Yamagishi Toshio and Tomaselli Gordon F. (1998). Structure and function of voltage-gated sodium channels. The Journal of Physiology 508 (3): 647–657. ISSN 0022-3751. doi:10.1111/j.1469-7793.1998.647bp.x.
- Stuart Greg and Häusser Michael (1994). Initiation and spread of sodium action potentials in cerebellar purkinje cells. Neuron 13 (3): 703–712. ISSN 08966273. doi:10.1016/0896-6273(94)90037-X.
- Carr David B, Day Michelle, Cantrell Angela R, Held Joshua, Scheuer Todd, Catterall William, and Surmeier D.James (2003). Transmitter Modulation of Slow, Activity-Dependent Alterations in Sodium Channel Availability Endows Neurons with a Novel Form of Cellular Plasticity. Neuron 39 (5): 793–806. ISSN 08966273. doi:10.1016/S0896-6273(03)00531-2.
- Johnston Daniel and Narayanan Rishikesh (2008). Active dendrites: colorful wings of the mysterious butterflies. Trends in Neurosciences 31 (6): 309–316. ISSN 01662236. doi:10.1016/j.tins.2008.03.004.
- Shah Mala M., Hammond Rebecca S., and Hoffman Dax A. (2010). Dendritic ion channel trafficking and plasticity. Trends in Neurosciences 33 (7): 307–316. ISSN 01662236. doi:10.1016/j.tins.2010.03.002.
- Stuart Greg J. and Häusser Michael (2001). Dendritic coincidence detection of EPSPs and action potentials. Nature Neuroscience 4 (1): 63–71. ISSN 10976256. doi:10.1038/82910.
- Bekkers John M. (2000). Distribution and activation of voltage-gated potassium channels in cell-attached and outside-out patches from large layer 5 cortical pyramidal neurons of the rat. The Journal of Physiology 525 (3): 611–620. ISSN 0022-3751. doi:10.1111/j.1469-7793.2000.t01-2-00611.x.
- Williams, Stephen R. and Stuart Greg J. (15 лютого 2000). Action Potential Backpropagation and Somato-dendritic Distribution of Ion Channels in Thalamocortical Neurons. The Journal of Neuroscience 20: 1307–1317.
- Korngreen Alon and Sakmann Bert (2000). Voltage-gated K+ channels in layer 5 neocortical pyramidal neurones from young rats: subtypes and gradients. The Journal of Physiology 525 (3): 621–639. ISSN 0022-3751. doi:10.1111/j.1469-7793.2000.00621.x.
- Cai Xiang, Liang Conrad W., Muralidharan Sukuman, Kao Joseph P.Y., Tang Cha-Min, and Thompson Scott M. (2004). Unique Roles of SK and Kv4.2 Potassium Channels in Dendritic Integration. Neuron 44 (2): 351–364. ISSN 08966273. doi:10.1016/j.neuron.2004.09.026.
- Adelman John P., Maylie James, and Sah Pankaj (2012). Small-Conductance Ca2+-Activated K+Channels: Form and Function. Annual Review of Physiology 74 (1): 245–269. ISSN 0066-4278. doi:10.1146/annurev-physiol-020911-153336.
- Ngo-Anh Thu Jennifer, Bloodgood Brenda L, Lin Michael, Sabatini Bernardo L, Maylie James, and Adelman John P (2005). SK channels and NMDA receptors form a Ca2+-mediated feedback loop in dendritic spines. Nature Neuroscience 8 (5): 642–649. ISSN 1097-6256. doi:10.1038/nn1449.
- Stocker Martin (2004). Ca2+-activated K+ channels: molecular determinants and function of the SK family. Nature Reviews Neuroscience 5 (10): 758–770. ISSN 1471-003X. doi:10.1038/nrn1516.
- Ohtsuki Gen, Piochon Claire, Adelman John P., and Hansel Christian (2012). SK2 Channel Modulation Contributes to Compartment-Specific Dendritic Plasticity in Cerebellar Purkinje Cells. Neuron 75 (1): 108–120. ISSN 08966273. doi:10.1016/j.neuron.2012.05.025.
- Hibin H., Inanobe A., Furutani K., and Murakami S. (2010). Inwardly Rectifying Potassium Channels: Their Structure, Function, and Physiological Roles. Physiological Reviews 90 (1): 291–366. ISSN 0031-9333. doi:10.1152/physrev.00021.2009.
- Luján Rafael, Maylie James, and Adelman John P. (2009). New sites of action for GIRK and SK channels. Nature Reviews Neuroscience 10 (7): 475–480. ISSN 1471-003X. doi:10.1038/nrn2668.
- Huang Cindy Shen, Shi Song-Hai, Ule Jernej, Ruggiu Matteo, Barker Laura A., Darnell Robert B., Jan Yuh Nung, and Jan Lily Yeh (2005). Common Molecular Pathways Mediate Long-Term Potentiation of Synaptic Excitation and Slow Synaptic Inhibition. Cell 123 (1): 105–118. ISSN 00928674. doi:10.1016/j.cell.2005.07.033.
- Angelo K., London M., and Christensen S. R. (2007). Local and Global Effects of Ih Distribution in Dendrites of Mammalian Neurons. Journal of Neuroscience 27 (32): 8643–8653. ISSN 0270-6474. doi:10.1523/JNEUROSCI.5284-06.2007.
- Kole Maarten H.P., Hallermann Stefan, and Stuart Greg J. (2006). Single Ih Channels in Pyramidal Neuron Dendrites: Properties, Distribution, and Impact on Action Potential Output. Journal of Neuroscience 26 (6): 1677–1687. ISSN 0270-6474. doi:10.1523/JNEUROSCI.3664-05.2006.
- Magee Jeffrey C. (1999). Dendritic Ih normalizes temporal summation in hippocampal CA1 neurons. Nature Neuroscience 2 (6): 508–514. ISSN 10976256. doi:10.1038/9158.
- Wang Zhiru, Xu Ning-long, Wu Chien-ping, Duan Shumin, and Poo Mu-ming (2003). Bidirectional Changes in Spatial Dendritic Integration Accompanying Long-Term Synaptic Modifications. Neuron 37 (3): 463–472. ISSN 08966273. doi:10.1016/S0896-6273(02)01189-3.
- Sakakibara Manabu, Honnuraiah Suraj, and Narayanan Rishikesh (2013). A Calcium-Dependent Plasticity Rule for HCN Channels Maintains Activity Homeostasis and Stable Synaptic Learning. PLoS ONE 8 (2): e55590. ISSN 1932-6203. doi:10.1371/journal.pone.0055590.
- Biel M., Wahl-Schott C., Michalakis S., Zong X. (2009). Hyperpolarization-Activated Cation Channels: From Genes to Function. Physiological Reviews 89 (3): 847–885. ISSN 0031-9333. doi:10.1152/physrev.00029.2008.
- Ulrich Daniel (2002). Dendritic resonance in rat neocortical pyramidal cells. Journal of Neurophysiology 87: 2753–2759.
- Williams S.R, Christensen S.R, Stuart G.J, and Hausser M. (2002). Membrane potential bistability is controlled by the hyperpolarization-activated current IH in rat cerebellar Purkinje neurons in vitro. The Journal of Physiology 539 (2): 469–483. ISSN 0022-3751. doi:10.1113/jphysiol.2001.013136.
- Tsay David, Dudman Joshua T., and Siegelbaum Steven A. (2007). HCN1 Channels Constrain Synaptically Evoked Ca2+ Spikes in Distal Dendrites of CA1 Pyramidal Neurons. Neuron 56 (6): 1076–1089. ISSN 08966273. doi:10.1016/j.neuron.2007.11.015.
- Anwar H., Hepburn I., Nedelescu H., Chen, W., and De Schutter E. (2013). Stochastic Calcium Mechanisms Cause Dendritic Calcium Spike Variability. Journal of Neuroscience 33 (40): 15848–15867. ISSN 0270-6474. doi:10.1523/JNEUROSCI.1722-13.2013.
- Sabatini Bernardo L., Maravall Miguel, and Svoboda Karel (2001). Ca2+ signaling in dendritic spines. Current Opinion in Neurobiology 11 (3): 349–356. ISSN 09594388. doi:10.1016/S0959-4388(00)00218-X.
- Kostyuk Platon G. (1989). Diversity of calcium ion channels in cellular membranes. Neuroscience 28 (2): 253–261. ISSN 03064522. doi:10.1016/0306-4522(89)90177-2.
- Tsien R.W. (1983). Calcium Channels in Excitable Cell Membranes. Annual Review of Physiology 45 (1): 341–358. ISSN 0066-4278. doi:10.1146/annurev.ph.45.030183.002013.
- Kavalali Ege T, Zhuo Min, Bito Haruhiko, and Tsien Richard W (1997). Dendritic Ca2+ Channels Characterized by Recordings from Isolated Hippocampal Dendritic Segments. Neuron 18 (4): 651–663. ISSN 08966273. doi:10.1016/S0896-6273(00)80305-0.
- Schneider E. R., Civillico E. F., and Wang S. S.- H. (2013). Calcium-based dendritic excitability and its regulation in the deep cerebellar nuclei. Journal of Neurophysiology 109 (9): 2282–2292. ISSN 0022-3077. doi:10.1152/jn.00925.2012.
- Helmchen Fritjof, Svoboda Karel, Denk Winfried and Tank David W. (1999). Nature Neuroscience 2 (11): 989–996. ISSN 10976256. doi:10.1038/14788.
- Kostyuk Platon G. (1999). Low-voltage activated calcium channels: achievements and problems. Neuroscience 92 (4): 1157–1163. ISSN 03064522. doi:10.1016/S0306-4522(99)00221-3.
- Higley Michael J. and Sabatini Bernardo L. (2008). Calcium Signaling in Dendrites and Spines: Practical and Functional Considerations. Neuron 59 (6): 902–913. ISSN 08966273. doi:10.1016/j.neuron.2008.08.020.
- Westenbroek Ruth E., Ahlijanian Michael K., and Catterall William A. (1990). Clustering of L-type Ca2+ channels at the base of major dendrites in hippocampal pyramidal neurons. Nature 347 (6290): 281–284. ISSN 0028-0836. doi:10.1038/347281a0.
- Kostyuk Platon G. (1981). Calcium channels in the neuronal membrane. Biochimica et Biophysica Acta (BBA) - Reviews on Biomembranes 650 (2-3): 128–150. ISSN 03044157. doi:10.1016/0304-4157(81)90003-4.
- Usowicz Maria M., Sugimori Mutsuyuki, Cherksey Bruce, and Llinás Rodolfo (1992). P-type calcium channels in the somata and dendrites of adult cerebellar purkinje cells. Neuron 9 (6): 1185–1199. ISSN 08966273. doi:10.1016/0896-6273(92)90076-P.
- Grienberger Christine and Konnerth Arthur (2012). Imaging Calcium in Neurons. Neuron 73 (5): 862–885. ISSN 08966273. doi:10.1016/j.neuron.2012.02.011.
- Randall A.D. and Tsien R.W. (1997). Contrasting biophysical and pharmacological properties of T-type and R-type calcium channels. Neuropharmacology 36 (7): 879–893. ISSN 00283908. doi:10.1016/S0028-3908(97)00086-5.
- Hanson Jesse E., Smith Yoland (2002). Subcellular distribution of high-voltage-activated calcium channel subtypes in rat globus pallidus neurons. The Journal of Comparative Neurology 442 (2): 89–98. ISSN 0021-9967. doi:10.1002/cne.10075.
- Magee Jeffrey, Hoffman Dax, Colbert Costa, and Johnston Daniel (1998). Electrical and calcium signaling in dendrites of hippocampal pyramidal neurons. Annual Review of Physiology 60 (1): 327–346. ISSN 0066-4278. doi:10.1146/annurev.physiol.60.1.327.
- Takahashi Hiroto and Magee Jeffrey C. (2009). Pathway Interactions and Synaptic Plasticity in the Dendritic Tuft Regions of CA1 Pyramidal Neurons. Neuron 62 (1): 102–111. ISSN 08966273. doi:10.1016/j.neuron.2009.03.007.
- Svoboda Karel and Sabatini Bernardo L. (2000). Nature 408 (6812): 589–593. ISSN 00280836. doi:10.1038/35046076.
- Llinás R. and Sugimori M. (1 серпня 1980). Electrophysiological properties of in vitro Purkinje cell dendrites in mammalian cerebellar slices.. The Journal of Physiology 305: 197–213. PMID 7441553.
- Womack M. D. and Khodakhah Kamran (2004). Dendritic Control of Spontaneous Bursting in Cerebellar Purkinje Cells. Journal of Neuroscience 24 (14): 3511–3521. ISSN 0270-6474. doi:10.1523/JNEUROSCI.0290-04.2004.
- Bergquist Filip, Shahabi Haydeh Niazi, and Nissbrandt Hans (2003). Somatodendritic dopamine release in rat substantia nigra influences motor performance on the accelerating rod. Brain Research 973 (1): 81–91. ISSN 00068993. doi:10.1016/S0006-8993(03)02555-1.
- Blackwell, Kim (2013). Calcium: The Answer to Life, the Universe, and Everything. У Bower, James M. 20 Years of Computational Neuroscience. с. 141–158. ISBN 978-1-4614-1424-7.
- Zucker Robert S (1999). Calcium- and activity-dependent synaptic plasticity. Current Opinion in Neurobiology 9 (3): 305–313. ISSN 09594388. doi:10.1016/S0959-4388(99)80045-2.
- Корогод, С.М. and І.Б. Кулагіна (2012). Динамічні електричні стани неоднорідних популяцій іонних каналів у мембранах збудливих клітин. Фізіологічний журнал 58 (3): 50–59. Архів оригіналу за 14 жовтня 2013. Процитовано 6 жовтня 2013.
- Oesch Nicholas, Euler Thomas, Taylor W. Rowland (2005). Direction-Selective Dendritic Action Potentials in Rabbit Retina. Neuron 47 (5): 739–750. ISSN 08966273. doi:10.1016/j.neuron.2005.06.036.
- Schiller Jackie and Schiller Yitzhak (2001). NMDA receptor-mediated dendritic spikes and coincident signal amplification. Current Opinion in Neurobiology 11 (3): 343–348. ISSN 09594388. doi:10.1016/S0959-4388(00)00217-8.
- Segev Idan and Rall Wilfrid (1998b). Excitable dendrites and spines: earlier theoretical insights elucidate recent direct observations. Trends in Neurosciences 21 (11): 453–460. ISSN 01662236. doi:10.1016/S0166-2236(98)01327-7.
- Chen W.R., Midtgaard J., and Shepherd G.M. (1997). Forward and Backward Propagation of Dendritic Impulses and Their Synaptic Control in Mitral Cells. Science 278 (5337): 463–467. ISSN 00368075. doi:10.1126/science.278.5337.463.
- Stuart G, Schiller J, and Sakmann B. (15 грудня 1997). Action potential initiation and propagation in rat neocortical pyramidal neurons.. The Journal of Physiology 505 (3): 617 – 632. PMID 9457640.
- Schiller Jackie, Schiller Yitzhak, Stuart Greg, and Sakmann Bert (1997). Calcium action potentials restricted to distal apical dendrites of rat neocortical pyramidal neurons. The Journal of Physiology 505 (3): 605–616. ISSN 0022-3751. doi:10.1111/j.1469-7793.1997.605ba.x.
- Golding Nace L and Spruston Nelson (1998). Dendritic Sodium Spikes Are Variable Triggers of Axonal Action Potentials in Hippocampal CA1 Pyramidal Neurons. Neuron 21 (5): 1189–1200. ISSN 08966273. doi:10.1016/S0896-6273(00)80635-2.
- Lebedeva S.A., Stepanyuk A. R., and Belan P. V. (2013). Local Signalization in Dendrites and Mechanisms of Short-Term Memory. Neurophysiology 45 (4): 359–367. ISSN 0090-2977. doi:10.1007/s11062-013-9381-6.
- Reyes Alex (2001). Influence of dendritic conductances on the input-output properties of neurons. Annual Review of Neuroscience 24 (1): 653–675. ISSN 0147-006X. doi:10.1146/annurev.neuro.24.1.653.
- Raastad Morten and Lipowski Rupert (1996). Diversity of Postsynaptic Amplitude and Failure Probability of Unitary Excitatory Synapses between CA3 and CA1 Cells in the Rat Hippocampus. European Journal of Neuroscience 8 (6): 1265–1274. ISSN 0953816X. doi:10.1111/j.1460-9568.1996.tb01295.x.
- Poznanski R.R. and Bell J. (2000). A dendritic cable model for the amplification of synaptic potentials by an ensemble average of persistent sodium channels. Mathematical Biosciences 166 (2): 101–121. ISSN 00255564. doi:10.1016/S0025-5564(00)00031-6.
- Oviedo Hysell and Reyes Alex D. (2002). Boosting of neuronal firing evoked with asynchronous and synchronous inputs to the dendrite. Nature Neuroscience 5 (3): 261–266. ISSN 10976256. doi:10.1038/nn807.
- Schwindt Peter and Crill Wayne (1 березня 1999). Mechanisms Underlying Burst and Regular Spiking Evoked by Dendritic Depolarization in Layer 5 Cortical Pyramidal Neurons. Journal of neurophysiology 81 (3): 1341–1354. PMID 10085360.
- Johnston D, Magee JC, Colbert CM, Christie BR (1996). Active Properties of Neuronal Dendrites. Annual Review of Neuroscience 19 (1): 165–186. ISSN 0147-006X. doi:10.1146/annurev.ne.19.030196.001121.
- Shepherd G.M., Brayton R.K., Miller J.P., Segev I., Rinzel J., and Rall W. (1 квітня 1985). Signal enhancement in distal cortical dendrites by means of interactions between active dendritic spines. PNAS 82: 2192–2195.
- Softky W. (1994). Sub-millisecond coincidence detection in active dendritic trees. Neuroscience 58 (1): 13–41. ISSN 03064522. doi:10.1016/0306-4522(94)90154-6.
- Shadlen Michael N. and Newsome William T. (1994). Noise, neural codes and cortical organization. Current Opinion in Neurobiology 4 (4): 569–579. ISSN 09594388. doi:10.1016/0959-4388(94)90059-0.
- Softky William R (1995). Simple codes versus efficient codes. Current Opinion in Neurobiology 5 (2): 239–247. ISSN 09594388. doi:10.1016/0959-4388(95)80032-8.
- Nowak L., Bregestovski P., Ascher P., Herbet A., and Prochiantz A. (1984). Magnesium gates glutamate-activated channels in mouse central neurones. Nature 307 (5950): 462–465. ISSN 0028-0836. doi:10.1038/307462a0.
- MacDermott A.B., Mayer.L., Westbrook G.L., Smith S.J., and Barker J.L. (1986). NMDA-receptor activation increases cytoplasmic calcium concentration in cultured spinal cord neurones. Nature 321 (6069): 519–522. ISSN 0028-0836. doi:10.1038/321519a0.
- Bloodgood Brenda L. and Sabatini Bernardo L. (2007). Nonlinear Regulation of Unitary Synaptic Signals by CaV2.3 Voltage-Sensitive Calcium Channels Located in Dendritic Spines. Neuron 53 (2): 249–260. ISSN 08966273. doi:10.1016/j.neuron.2006.12.017.
- Clapham David E., Schiller Jackie and Schiller Yitzhak (1998). Nature Neuroscience 1 (2): 114–118. ISSN 10976256. doi:10.1038/363.
- Nicholson N.A., Trana R., Katz Y., Kath W.L., Spruston N., and Geinisman Y. (2006). Distance-Dependent Differences in Synapse Number and AMPA Receptor Expression in Hippocampal CA1 Pyramidal Neurons. Neuron 50 (3): 431–442. ISSN 08966273. doi:10.1016/j.neuron.2006.03.022.
- Jarsky T., Alex Roxin A., Kath W.L. and Spruston N. (20 листопада 2005). Conditional dendritic spike propagation following distal synaptic activation of hippocampal CA1 pyramidal neurons. Nature Neuroscience (8): 1667 – 1676. doi:10.1038/nn1599.
- Larkum Matthew E., Zhu J. Julius, and Sakmann Bert (1999). A new cellular mechanism for coupling inputs arriving at different cortical layers. Nature 398 (6725): 338–341. ISSN 00280836. doi:10.1038/18686.
- Mel, BW. (1992). The clusteron: toward a simple abstraction for a complex neuron.. У Moody J. , Hanson S. , & R. Lippmann. Advances in neural information processing systems. Morgan Kaufmann Publishers. с. 35-42. ISBN 9781558602229.
- Poirazi Panayiota and Mel Bartlett W. (2001). Impact of Active Dendrites and Structural Plasticity on the Memory Capacity of Neural Tissue. Neuron 29 (3): 779–796. ISSN 08966273. doi:10.1016/S0896-6273(01)00252-5.
- Nevian T, Larkum ME, Polsky A, and Schiller J. (7 січня 2007). Properties of basal dendrites of layer 5 pyramidal neurons: a direct patch-clamp recording study.. Nature Neuroscience (2): 206 – 214. PMID 17206140. doi:10.1038/nn1826.
- Rall, Wilfrid (1977). Core Conductor Theory and Cable Properties of Neurons. У Mountcastle, Vernon B. Handbook of Physiology, The Nervous System, Cellular Biology of Neurons. American Physiological Society. с. 39–97. ISBN 0683045059.
- Hausser M. (27 жовтня 2000). Diversity and Dynamics of Dendritic Signaling. Science 290: 739–744. doi:10.1126/science.290.5492.739.
- Rumsey Clifton C. and Abbott L. F. (12 липня 2006). Synaptic Democracy in Active Dendrites.. Journal of Neurophysiology 96 (5): 2307–2318. doi:10.1152/jn.00149.2006.
- Roth A. and Hausser M. (1 вересня 2001). Compartmental models of rat cerebellar Purkinje cells based on simultaneous somatic and dendritic patchclamp recordings. The Journal of Physiology 535: 445–472. doi:10.1111/j.1469-7793.2001.00445.x.[недоступне посилання з серпня 2019]
- Miyata M, Finch EA, Khiroug L, Hashimoto K, Hayasaka S, Oda SI, Inouye M, Takagishi Y, Augustine GJ, and Kano M. (1 жовтня 2000). Local calcium release in dendritic spines required for long-term synaptic depression. Neuron 28 (1): 233–244. PMID 11086997.
- Williams SR. (22 серпня 2004). Spatial compartmentalization and functional impact of conductance in pyramidal neurons. Nature Neuroscience 7: 961 – 967. doi:10.1038/nn1305.
- Archie Kevin A. and Mel Bartlett W. (2000). A model for intradendritic computation of binocular disparity. Nature Neuroscience 3 (1): 54–63. ISSN 10976256. doi:10.1038/71125.
- Remme Michiel W.H., Lengyel Máté and Gutkin Boris S. (2010). Democracy-Independence Trade-Off in Oscillating Dendrites and Its Implications for Grid Cells. Neuron 66 (3): 429–437. ISSN 08966273. doi:10.1016/j.neuron.2010.04.027.
- Polsky Alon, Mel Bartlett W, and Schiller Jackie (2004). Computational subunits in thin dendrites of pyramidal cells. Nature Neuroscience 7 (6): 621–627. ISSN 1097-6256. doi:10.1038/nn1253.
- Losonczy Attila and Magee Jeffrey C. (2006). Integrative Properties of Radial Oblique Dendrites in Hippocampal CA1 Pyramidal Neurons. Neuron 50 (2): 291–307. ISSN 08966273. doi:10.1016/j.neuron.2006.03.016.
- Losonczy Attila, Makara Judit K., and Magee Jeffrey C. (2008). Compartmentalized dendritic plasticity and input feature storage in neurons. Nature 452 (7186): 436–441. ISSN 0028-0836. doi:10.1038/nature06725.
- Mel Bartlett W. (1994). Information Processing in Dendritic Trees. Neural Computation 6 (6): 1031–1085. ISSN 0899-7667. doi:10.1162/neco.1994.6.6.1031.
- Poirazi Panayiota, Brannon Terrence and Mel Bartlett W. (2003). Pyramidal Neuron as Two-Layer Neural Network. Neuron 37 (6): 989–999. ISSN 08966273. doi:10.1016/S0896-6273(03)00149-1.
- Spruston Nelson and Kath William L (2004). Dendritic arithmetic. Nature Neuroscience 7 (6): 567–569. ISSN 1097-6256. doi:10.1038/nn0604-567.
- Katz Yael, Menon Vilas, Nicholson Daniel A., Geinisman Yuri, Kath William L., and Spruston Nelson (2009). Synapse Distribution Suggests a Two-Stage Model of Dendritic Integration in CA1 Pyramidal Neurons. Neuron 63 (2): 171–177. ISSN 08966273. doi:10.1016/j.neuron.2009.06.023.
- Major G., Polsky A., Denk W., Schiller J., and Tank D.W. (2008). Spatiotemporally Graded NMDA Spike/Plateau Potentials in Basal Dendrites of Neocortical Pyramidal Neurons. Journal of Neurophysiology 99 (5): 2584–2601. ISSN 0022-3077. doi:10.1152/jn.00011.2008.
- Branco T., Clark B. A. and Hausser M. (2010). Dendritic Discrimination of Temporal Input Sequences in Cortical Neurons. Science 329 (5999): 1671–1675. ISSN 0036-8075. doi:10.1126/science.1189664.
- Wang Yingxue and Liu Shih-Chii (2010). Multilayer Processing of Spatiotemporal Spike Patterns in a Neuron with Active Dendrites. Neural Computation 22 (8): 2086–2112. ISSN 0899-7667. doi:10.1162/neco.2010.06-09-1030.
- Gasparini S. and Magee (2006). State-Dependent Dendritic Computation in Hippocampal CA1 Pyramidal Neurons. Journal of Neuroscience 26 (7): 2088–2100. ISSN 0270-6474. doi:10.1523/JNEUROSCI.4428-05.2006.
- Hebb, Donald Olding (1987). Textbook of Psychology. Erlbaum. с. 384. ISBN 9780898599343.
- London Michael and Häusser Michael (2005). Dendritic computation. Annual Review of Neuroscience 28 (1): 503–532. ISSN 0147-006X. doi:10.1146/annurev.neuro.28.061604.135703.
- Sjostrom P. J., Rancz E. A., Roth A., Hausser M. (2008). Dendritic Excitability and Synaptic Plasticity. Physiological Reviews 88 (2): 769–840. ISSN 0031-9333. doi:10.1152/physrev.00016.2007.
- Sjöström P. and Nelson S. (2002). Spike timing, calcium signals and synaptic plasticity. Current Opinion in Neurobiology 12 (3): 305–314. ISSN 09594388. doi:10.1016/S0959-4388(02)00325-2.
- Johnston D., Christie B. R., Frick A., Gray R., Hoffman D. A., Schexnayder L. K., Watanabe S., and Yuan L.-L. (2003). Active dendrites, potassium channels and synaptic plasticity. Philosophical Transactions of the Royal Society B: Biological Sciences 358 (1432): 667–674. ISSN 0962-8436. doi:10.1098/rstb.2002.1248.
- Kampa B. M., Letzkus J. J., and Stuart G. J. (2006). Requirement of dendritic calcium spikes for induction of spike-timing-dependent synaptic plasticity. The Journal of Physiology 574 (1): 283–290. ISSN 0022-3751. doi:10.1113/jphysiol.2006.111062.
- Han E.B. and Heinemann S.F. (2013). Distal Dendritic Inputs Control Neuronal Activity by Heterosynaptic Potentiation of Proximal Inputs. Journal of Neuroscience 33 (4): 1314–1325. ISSN 0270-6474. doi:10.1523/JNEUROSCI.3219-12.2013.
- Takahashi N., Kitamura K., Matsuo N., Mayford M., Kano M., Matsuki N., Ikegaya Y. (2012). Locally Synchronized Synaptic Inputs. Science 335 (6066): 353–356. ISSN 0036-8075. doi:10.1126/science.1210362.
- Smith Spencer L., Smith Ikuko T., Branco Tiago and Häusser Michael (2013). Dendritic spikes enhance stimulus selectivity in cortical neurons in vivo. Nature. ISSN 0028-0836. doi:10.1038/nature12600.
- Sivyer Benjamin and Williams Stephen R (2013). Direction selectivity is computed by active dendritic integration in retinal ganglion cells. Nature Neuroscience. ISSN 1097-6256. doi:10.1038/nn.3565.
- Larkum Matthew (2013). A cellular mechanism for cortical associations: an organizing principle for the cerebral cortex. Trends in Neurosciences 36 (3): 141–151. ISSN 01662236. doi:10.1016/j.tins.2012.11.006.
- Agmon-Snir Hagai, Carr Catherine E. and Rinzel John (1998). The role of dendrites in auditory coincidence detection. Nature 393 (6682): 268–272. ISSN 00280836. doi:10.1038/30505.
- Grienberger Christine, Adelsberger Helmuth, Stroh Albrecht, Milos Ruxandra-Iulia, Garaschuk Olga, Schierloh Anja, Nelken Israel, and Konnerth Arthur (2011). Sound-evoked network calcium transients in mouse auditory cortex in vivo. The Journal of Physiology: no–no. ISSN 00223751. doi:10.1113/jphysiol.2011.222513.
- Purpura D. P. (1974). Dendritic Spine "Dysgenesis" and Mental Retardation. Science 186 (4169): 1126–1128. ISSN 0036-8075. doi:10.1126/science.186.4169.1126.
- Marin-Padilla Miguel (1972). Structural abnormalities of the cerebral cortex in human chromosomal aberrations: a Golgi study. Brain Research 44 (2): 625–629. ISSN 00068993. doi:10.1016/0006-8993(72)90324-1.
- Scheibel Madge E. and Scheibel Arnold B. (1977). Differential Changes with Aging in Old and New Cortices 23. с. 39–58. ISSN 0099-6246. doi:10.1007/978-1-4684-3093-6_4.
- Kaufmann W. E. and Moser Hugo W. (2000). Dendritic Anomalies in Disorders Associated with Mental Retardation. Cerebral Cortex 10 (10): 981–991. ISSN 14602199. doi:10.1093/cercor/10.10.981.
- Dierssen M. and Ramakers G.J.A. (2006). Dendritic pathology in mental retardation: from molecular genetics to neurobiology. Genes, Brain and Behavior 5: 48–60. ISSN 16011848. doi:10.1111/j.1601-183X.2006.00224.x.
- Meuth Sven G., Bittner Tobias, Fuhrmann Martin, Burgold Steffen, Ochs Simon M., Hoffmann Nadine, Mitteregger Gerda, Kretzschmar Hans, LaFerla Frank M., and Herms Jochen (2010). Multiple Events Lead to Dendritic Spine Loss in Triple Transgenic Alzheimer's Disease Mice. PLoS ONE 5 (11): e15477. ISSN 1932-6203. doi:10.1371/journal.pone.0015477.
- Nitkin R. M. (2000). Dendritic Mechanisms in Brain Function and Developmental Disabilities. Cerebral Cortex 10 (10): 925–926. ISSN 14602199. doi:10.1093/cercor/10.10.925.
- Fiala John C., Spacek Josef, and Harris Kristen M (2002). Dendritic Spine Pathology: Cause or Consequence of Neurological Disorders?. Brain Research Reviews 39 (1): 29–54. ISSN 01650173. doi:10.1016/S0165-0173(02)00158-3.
- Kulkarni Vaishali A. and Firestein Bonnie L. (2012). The dendritic tree and brain disorders. Molecular and Cellular Neuroscience 50 (1): 10–20. ISSN 10447431. doi:10.1016/j.mcn.2012.03.005.
- Ribak Charles E., Tran Peter H., Spigelman Igor, Okazaki Maxine M. and Nadler J. Victor (2000). Status epilepticus-induced hilar basal dendrites on rodent granule cells contribute to recurrent excitatory circuitry. The Journal of Comparative Neurology 428 (2): 240–253. ISSN 0021-9967. doi:10.1002/1096-9861(20001211)428:2<240::AID-CNE4>3.0.CO;2-Q.
- Grill Joshua D. and Riddle David R. (2002). Age-related and laminar-specific dendritic changes in the medial frontal cortex of the rat. Brain Research 937 (1-2): 8–21. ISSN 00068993. doi:10.1016/S0006-8993(02)02457-5.
- Falke Eric, Nissanov Jonathan, Mitchell Thomas W., Bennett David A., Trojanowski John Q., =Arnold Steven E. (2003). Subicular Dendritic Arborization in Alzheimer's Disease Correlates with Neurofibrillary Tangle Density. The American Journal of Pathology 163 (4): 1615–1621. ISSN 00029440. doi:10.1016/S0002-9440(10)63518-3.
- Yu Wendou and Lu Bingwei (2012). Synapses and Dendritic Spines as Pathogenic Targets in Alzheimer’s Disease. Neural Plasticity 2012: 1–8. ISSN 2090-5904. doi:10.1155/2012/247150.
- Penzes eter, Cahill Michael E., Jones Kelly A, VanLeeuwen Jon-Eric, and Woolfrey Kevin M (2011). Dendritic spine pathology in neuropsychiatric disorders. Nature Neuroscience 14 (3): 285–293. ISSN 1097-6256. doi:10.1038/nn.2741.
- Bennett M.R. (2011). Schizophrenia: susceptibility genes, dendritic-spine pathology and gray matter loss. Progress in Neurobiology 95 (3): 275–300. ISSN 03010082. doi:10.1016/j.pneurobio.2011.08.003.
- Glausier J.R. and Lewis D.A. (2013). Dendritic spine pathology in schizophrenia. Neuroscience 251: 90–107. ISSN 03064522. doi:10.1016/j.neuroscience.2012.04.044.
- Morse Thomas M., Carnevale Nicholas T., Mutalik Pradeep G., Migliore Michele, and Shepherd Gordon M. (2010). Abnormal excitability of oblique dendrites implicated in early Alzheimer's: a computational study. Frontiers in Neural Circuits. ISSN 16625110. doi:10.3389/fncir.2010.00016.
- Zhang Shengxiang, Wang Jiangbi and Wang Lei (2010). Structural plasticity of dendritic spines. Frontiers in Biology 5 (1): 48–58. ISSN 1674-7984. doi:10.1007/s11515-010-0011-z.
- Windhorst Uwe , Johansson Håkan J, ред. (1999). Modern Techniques in Neuroscience Research: 33 Tables. Springer. с. 1325. ISBN 9783540644606.
- Walz Wolfgang , Baker Glen B. , Boulton Alan A., ред. (2002). Patch-Clamp Analysis: Advanced Techniques. Springer. с. 346. ISBN 9781592592760.
- Noguchi Jun, Nagaoka Akira, Watanabe Satoshi, Ellis-Davies Graham C. R., Kitamura Kazuo, Kano Masanobu, Matsuzaki Masanori, Kasai Haruo (2011). In vivo two-photon uncaging of glutamate revealing the structure-function relationships of dendritic spines in the neocortex of adult mice. The Journal of Physiology 589 (10): 2447–2457. ISSN 00223751. doi:10.1113/jphysiol.2011.207100.
- Prinz Astrid A, Abbott L.F, Marder Eve (2004). The dynamic clamp comes of age. Trends in Neurosciences 27 (4): 218–224. ISSN 01662236. doi:10.1016/j.tins.2004.02.004.
- Chen T.W., Wardill T.J., Sun Y., Pulver S.R., Renninger S.L., Baohan A., Schreiter E.R., Kerr R.A., Orger M.B., Jayaraman V., Looger L.L., Svoboda K., and Kim D.S. (2013). Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature 499 (7458): 295–300. ISSN 0028-0836. doi:10.1038/nature12354.
- Yonehara K., Farrow K., Ghanem A., Hillier D., Balint K., Teixeira M., Jüttner J., Noda M., Neve R.L., Conzelmann K.-K., Roska B. (2013). The First Stage of Cardinal Direction Selectivity Is Localized to the Dendrites of Retinal Ganglion Cells. Neuron 79 (6): 1078–1085. ISSN 08966273. doi:10.1016/j.neuron.2013.08.005.
- Bartley SH and Bishop GH (31 грудня 1932). Factors determining the form of the electrical response from the optic cortex of the rabbit. American Journal of Physiology 103: 173–184.
- Bishop GH and Clare MH (1 травня 1952). Sites of origin of electric potentials in striate cortex. Journal of Neurophysiology 15: 201–220.
- Clare M.H. and Bishop G.H. (1956). Potential wave mechanisms in cat cortex. Electroencephalography and Clinical Neurophysiology 8 (4): 583–602. ISSN 0013-4694. doi:10.1016/0013-4694(56)90083-9.
- Bishop GH (1 липня 1956). Natural history of the nerve impulse. Physiological reviews 36: 376–399.
- Chang Hsiang-Tung (1 січня 1951). Dendritic potential of cortical neurons produced by direct electrical stimulation of the cerebral cortex. Journal of neurophysiology: 1 1–21.
- Grundfest H. (November, 1958). Electrophysiology and pharmacology of dendrites.. Electroencephalography and Clinical Neurophysiology 35: 22–41. PMID 13609538.
- Eccles, John Carew (1964). The physiology of synapses. Academic Press. с. 316.
- Eyzaguirre C and Kuffler SW (1955). Processes of excitation in the dendrites and in the soma of single isolated sensory nerve cells of the lobster and crayfish. The Journal of General Physiology 39 (1): 87–119. ISSN 0022-1295. doi:10.1085/jgp.39.1.87.
- Lorente de No, R. and Condouris G.A. (1959 April). Decremental Conduction in Peripheral Nerve. Integration of Stimuli in the Neuron. PNAS 45: 592–617.
- Koch Christof and Segev Idan, ред. (1998). Methods in Neuronal Modeling: From Ions to Networks. MIT Press. с. 671. ISBN 9780262112314.
- Rall, Wilfrid (2006). Wilfrid Rall. У Squire, Larry R. The History of Neuroscience in Autobiography, volume 5. с. 551–613. ISBN 978-0-12-370514-3.
- Shepherd, Gordon M. (2009). Creating Modern Neuroscience: The Revolutionary 1950s. Oxford University Press. с. 304. ISBN 9780199741472.
- Svensson, Carl-Magnus (2009). Dynamics of spatially extended dendrites (PhD thesis). с. 212.
- Lux HD and Pollen DA (1 березня 1966). Electrical constants of neurons in the motor cortex of the cat.. Journal of Neurophysiology 29: 207–220.
- Nelson P.G. and Lux H.D. (1970). Some Electrical Measurements of Motoneuron Parameters. Biophysical Journal 10 (1): 55–73. ISSN 00063495. doi:10.1016/S0006-3495(70)86285-3.
- Desmond Nancy L. and Levy William B. (1986). Changes in the postsynaptic density with long-term potentiation in the dentate gyrus. The Journal of Comparative Neurology 253 (4): 476–482. ISSN 0021-9967. doi:10.1002/cne.902530405.
- Larkman Alan U. (1991). Dendritic morphology of pyramidal neurones of the visual cortex of the rat: I. Branching patterns. The Journal of Comparative Neurology 306 (2): 307–319. ISSN 0021-9967. doi:10.1002/cne.903060207.
- Koch Christof and Segev Idan (2000). The role of single neurons in information processing. Nature Neuroscience 3 (Supp): 1171–1177. ISSN 10976256. doi:10.1038/81444.
- Chang Hsiang-Tung (1952). Cortical neurons with particular reference to the apical dendrites.. Cold Spring Harbor Symposia on Quantitative Biology 17 (0): 189–202. ISSN 0091-7451. doi:10.1101/SQB.1952.017.01.019.
- Chang, 1952, с. 200.
- Fatt P. (1 січня 1957). Electric potentials occurring around a neurone during its antidromic activation. Journal of Neurophysiology 20: 27–60.
- Andersen Per (1960). Interhippocampal Impulses. Acta Physiologica Scandinavica 48 (2): 178–208. ISSN 00016772. doi:10.1111/j.1748-1716.1960.tb01856.x.
- Cragg B. G. and Hamlyn L. H. (1955 September 28). Action potentials of the pyramidal neurones in the hippocampus of the rabbit. The Journal of Physiology 129: 608–627.
- Fujita Yasuichiro and Sakata Hideo (1962). Electrophysiological properties of CA1 and CA2 apical dendrites of rabbit hippocampus. Journal of Neurophysiology 25: 209–222.
- Wong R.K.S., D.A.Prince and Basbaum A.I (February 1979). Intradendritic recordings from hippocampal neurons. PNAS 76: 986–990.
Література
Монографії та підручники
- Вільям Ф. Ґанонґ. Фізіологія людини: Підручник/Переклад з англ. Наук.ред.перекладу М.Гжегоцький, В.Шевчук, О.Заячківська.—Львів: БаК, 2002.—784 с. ISBN 966-7065-38-3
- Николлс, Джон Г. (2012). От нейрона к мозгу. с. 671. ISBN 9785397022163.
- Stuart G, Spruston N, Hausser M., ред. (1999). Dendrites. Oxford University Press. с. 139–160. ISBN ISBN 0198566565.
- Segev I., Rinzel J. and Shepherd G., ред. (1995). The Theoretical Foundation of Dendritic Function: Selected Papers of Wilfrid Rall with Commentaries. MIT Press. с. 456. ISBN 9780262193566.
- Yuste, Rafael (2010). Dendritic Spines. MIT Press. с. 264. ISBN 9780262013505.
- Hille, Bertil (2001). Ionic Channels of Excitable Membranes. Sinauer Associates, Incorporated. с. 814. ISBN 9780878933211.
- Korogod Sergey M. and Suzanne Tyč-Dumont (2009). Electrical Dynamics of the Dendritic Space. Cambridge University Press. с. 211. ISBN 9781139481229.
- Tuckwell, Henry C. (1988). Introduction to Theoretical Neurobiology: volume 1, Linear Cable Theory and Dendritic Structure. Cambridge University Press. с. 304. ISBN 9780521350969.
- Koch, Christof (2004). Biophysics of Computation: Information Processing in Single Neurons. Oxford University Press. с. 562. ISBN 9780195181999.
- Koch Christof and Segev Idan, ред. (1998). Methods in Neuronal Modeling: From Ions to Networks. MIT Press. с. 671. ISBN 9780262112314.
- Galizia, C. Giovanni and Lledo, Pierre-Marie, ред. (2013). Neurosciences - From Molecule to Behavior: a university textbook. Springer. с. 736. ISBN 978-3-642-10769-6.
- Shepherd, Gordon M. (2009). Creating Modern Neuroscience: The Revolutionary 1950s. Oxford University Press. с. 304. ISBN 9780199741472.
- Squire, Larry, ред. (2008). Fundamental Neuroscience (вид. 3). с. 63. ISBN 978-0-12-374019-9.
- Ermentrout Bard and Terman David H. (2010). Mathematical Foundations of Neuroscience. Springer. с. 422. ISBN 9780387877075.
- Людина. / Навч. посібник з анатомії та фізіології. — Львів. 2002. — 240 с.
Оглядові статті
- Magee Jeffrey C and Johnston Daniel (2005). Plasticity of dendritic function. Current Opinion in Neurobiology 15 (3): 334–342. ISSN 09594388. doi:10.1016/j.conb.2005.05.013.
- Sjostrom P. J., Rancz E. A., Roth A., Hausser M. (2008). Dendritic Excitability and Synaptic Plasticity. Physiological Reviews 88 (2): 769–840. ISSN 0031-9333. doi:10.1152/physrev.00016.2007.
- Hausser M. (27 жовтня 2000). Diversity and Dynamics of Dendritic Signaling. Science 290: 739–744. doi:10.1126/science.290.5492.739.
- Major Guy, Larkum Matthew E. and Schiller Jackie (2013). Active Properties of Neocortical Pyramidal Neuron Dendrites. Annual Review of Neuroscience 36 (1): 1–24. ISSN 0147-006X. doi:10.1146/annurev-neuro-062111-150343.
- London Michael and Häusser Michael (2005). Dendritic computation. Annual Review of Neuroscience 28 (1): 503–532. ISSN 0147-006X. doi:10.1146/annurev.neuro.28.061604.135703.
- Johnston D, Magee JC, Colbert CM, Christie BR (1996). Active Properties of Neuronal Dendrites. Annual Review of Neuroscience 19 (1): 165–186. ISSN 0147-006X. doi:10.1146/annurev.ne.19.030196.001121.
- Mel Bartlett W. (1994). Information Processing in Dendritic Trees. Neural Computation 6 (6): 1031–1085. ISSN 0899-7667. doi:10.1162/neco.1994.6.6.1031.
- Kasai Haruo, Fukuda Masahiro, Watanabe Satoshi, Hayashi-Takag Akiko, and Noguchi Jun (2010). Structural dynamics of dendritic spines in memory and cognition. Trends in Neurosciences 33 (3): 121–129. ISSN 01662236. doi:10.1016/j.tins.2010.01.001.
- Johnston Daniel & Narayanan Rishikesh (2008). Active dendrites: colorful wings of the mysterious butterflies. Trends in Neurosciences 31 (6): 309–316. ISSN 01662236. doi:10.1016/j.tins.2008.03.004.
|
|
Ця стаття належить до вибраних статей Української Вікіпедії. |
.jpg.webp)