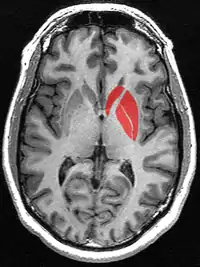
Смугасте тіло
Смугасте тіло (лат. corpus striatum) - підкіркове утворення переднього мозку і надзвичайно важливий компонент екстрапірамідної системи й системи винагород (англ. Reward System), яке отримує глутамінергічні та дофамінергічні імпульси з різних структур і служить вхідними воротами імпульсів до решти системи базальних гангліїв. У всіх приматів волокнами білої речовини, які називають внутрішньою капсулою, дорзальна частина смугастого тіла ділиться на дві частини, які називаються хвостате ядро і сочевицеподібне ядро. Вентральна частина складається з прилеглого ядра і нюхового горбка. Смугасте тіло координує декілька когнітивних функцій, включаючи рухи й їхнє планування, прийняття рішень, мотивації, підкріплення й винагороду.
| Смугасте тіло | |
|---|---|
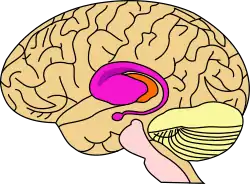 | |
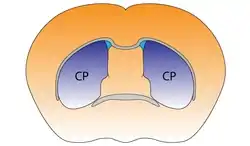 Дорзальна частина смугастого тіла миші | |
| Деталі | |
| Частина від |
Базальні ганглії, Екстрапірамідна система, Система винагород |
| Ідентифікатори | |
| Латина | Corpus striatum |
| Анатомія Грея | subject #189 |
| MeSH | D003342 |
| NeuroNames | 225 |
| NeuroLex ID | birnlex_1672 |
| TA98 | A14.1.09.516 і A14.1.09.515 |
| TA2 | 5559 |
| FMA | 77618[1] і 77616[1] |
| Анатомічна термінологія | |
Структура
Типи клітин
Смугасте тіло — гетерогенна структура з точки зору його компонентів — нейронів.[2]
- Шипуваті проекційні нейрони («середні шипуваті нейрони») є основними нейронами смугастого тіла[3], вони є ГАМК-ергічними, класифікуються як гальмівні й становлять 95 % від загальної популяції нейронів у стріатумі людини.[3] Середні шипуваті нейрони мають два основних фенотипи (тобто характерні типи): D1-Тип і D2-тип.[3][4][5]
- Холінергічні інтернейрони вивільняють ацетилхолін, який має цілий ряд важливих ефектів у смугастому тілі. У людини, інших приматів і гризунів, ці інтернейрони реагують на важливі стимули навколишнього середовища стереотипними відповідями, які врівноважуються з відповідями дофамін-ергічних нейронів чорної субстанції.[6][7] через дофамінові рецептори D5.[8]
- Є багато типів ГАМК-ергічних інтернейронів.[2] найбільш відомими є парвальбумін-позитивні, які беруть участь у потужному прямому гальмуванні основних нейронів.[9] крім того, є ГАМК-ергічні інтернейрони, які тропні до тирозин гідроксилази[10], соматостатину, синтази оксиду азоту та нейропептіда-Y[11] [12].
У дорослих людей постійно виробляються нові нейрони в смугастому тілі, і це може зіграти важливу роль у нових методах лікування нейродегенеративних розладів[13].
Анатомічні структурні елементи
Смугасте тіло поділяється на дорзальну й вентральну частини відповідно до анатомічного розташування і функціональних зв'язків. Вентральний стріатум складається з прилеглого ядра і нюхового горбка, в 'дорсальний стріатум входять хвостате ядро і лушпина.
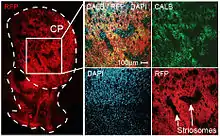
Дорсальний стріатум може бути диференційований відповідно до імунохімічних характеристик — зокрема, стосовно ацетилхолінестерази і кaльбіндину (див. мал. «Матриці і стріосомні відсіки»).
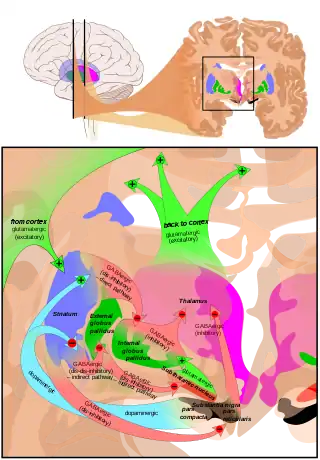
Аферентні зв'язки
Найважливішими з аферентних шляхів по кількості аксонів - кортикостріарні (від кори головного мозку до смугастого тіла). Багато зон кори мозку інервують дорсальний стріатум. Кіркові пірамідальні нейрони, які віддають свої аксони в смугасте тіло, знаходяться в шарах II—VІ, але найбільш щільні волокна приходять з шару V[15]. Вони, в основному, закінчуються на шипах шипуватих нейронів і є глутамін-ергічними нейронами. Інший відомий аферентних шлях - нігростріарний, що починається від нейронів pars compacta чорної субстанції. Також існують аференти від інших елементів базальних гангліїв, таких, як субталамічне ядро (глутамін-ергичні) чи зовнішня (покришкова) частина блідої кулі (ГАМК-ергічні).
Відцентрові (еферентні зв'язки)
Стріарні вихідні (еферентні, відцентрові) шляхи від вентральних і дорзальних компонентів, що складається в основному з середніх шипуватих нейронів, проекційних нейронів, які мають два основних фенотипи: «непрямі» з D2-типу рецепторами, і «прямі», з D1-типу рецепторами.[3][4]
Основа базальних гангліїв — це смугасте тіло разом з ділянками, з якими воно безпосередньо проекційно пов'язане через стріато-палідонігральні пучки — щільні, зі слабкомієлінізованими аксонами, що додає їм білуватого забарвлення. Ця проекція складається з покришкової та медулярної частин блідої кулі а також pars compacta і pars reticulata чорної субстанції. Нейрони цієї ділянки гальмуються ГАМК-ергічними синапсами від дорсального стріатума. З них лише бліда куля не посилає аксони за межі системи. Інші шлють аксони до верхніх горбків чотиригорбкового тіла, до додаткової моторної області, до передніх ядер таламуса, а звідти-в фронтальну ділянку кори.
Функція
Існують деякі відмінності в поглядах на функціонування смугастого тіла у дослідників, враховуючи різнорідність його елементів та участь їх у різних функціональних підсистемах.
У вентральному стріатумі і прилеглому ядрі зокрема, в першу чергу, модерується когнітивна функція системи винагороди (англ. reward cognition), підкріплення, мотиваційної значущості, в той час як дорзальний стріатум, у першу чергу, регулює пізнавальну рухову функцію, виконавчу функцію, і стимул-відповідь навчання;[3][16][4][17] і лише незначним чином їхні функції перекриваються — у дорсальному стріатумі теж є компонент системи винагороди, що разом із з прилеглим ядром, опосередковує кодування нових рухових програм, пов'язаних з майбутньою нагородою.[16][17]
Метаботропні рецептори дофаміну присутні як на шипах нейронів, так і на кіркових аксонових терминалях[18][19] У людини, смугасте тіло активується стимулами, пов'язаними з системою винагороди, а також із неприязню, новизною,[20] несподіванками або іншими інтенсивними емоційними подразниками[21] [22]
Клінічне значення
Хвороба Паркінсона
Хвороба Паркінсона призводить до втрати дофамінергічної іннервації в дорсальному стріатумі (та інших базальних гангліїях) та цілого каскаду наслідків. Атрофія стріатума також має місце при хворобі Гентінгтона, хореї, атетозі, і ДЦП.[23]
Залежність
Залежність, розлад мозкової системи винагород, виникає через надекспресія з ΔFosB, а транскрипційний фактор, в D1-Типі середніх шипуватих нейронів в вентральному стріатумі. ΔFosB — ген, який індукується прилеглому ядрі після високих доз наркотиків або інших сильних подразників, що можуть викликати залежність.[24][25]
Біполярний розлад
Генетичні дослідження показали зв'язок між стріарною експресією PDE10A гена й деякими біполярними розладами.[26]
Історія
У XVII і XVIII століттях термін «корпус стріатум» використовується для позначення безлічі різних, глибоких підкіркових елементах. у 1941 році, Сесіль і Оскар Фогт спростили номенклатуру, запропонувавши термін «стріатум» для всіх утворень, побудованих зі стріарних елементів : хвостатого ядра, лушпини, та інших.
Термін neostriatum був запропонований порівняльними анатомами, які досліджували підкіркові структури у хребетних, і зазначили, що це дійсно філогенетично більш нової частини смугастого тіла. Термін досі використовується в деяких джерелах[27]
Додаткові зображення
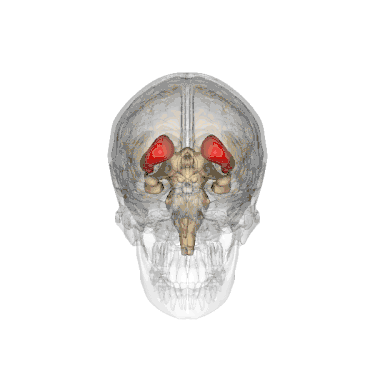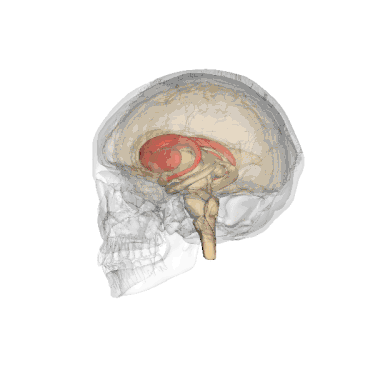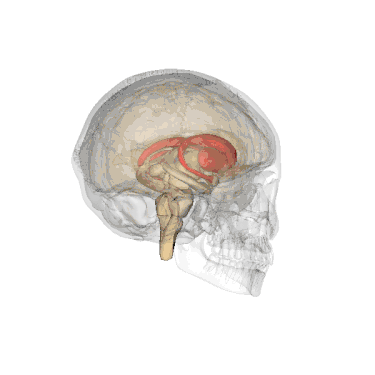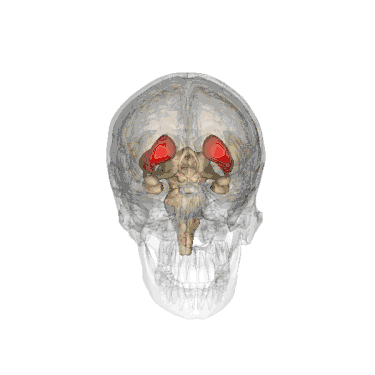 Анімоване зображення смугастого тіла
Анімоване зображення смугастого тіла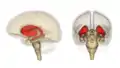 Смугасте тіло. Пряма й бокова проекції
Смугасте тіло. Пряма й бокова проекції
Посилання
- Foundational Model of Anatomy
- Tepper JM, Tecuapetla F, Koós T, Ibáñez-Sandoval O. Front Neuroanat. 2010 Dec 29;4:150. doi: 10.3389/fnana.2010.00150.
- Шаблон:Vcite2 journal
- Шаблон:Vcite2 journal
- Шаблон:Vcite2 journal
- Goldberg, JA; Reynolds, JN (December 2011). Spontaneous firing and evoked pauses in the tonically active cholinergic interneurons of the striatum.. Neuroscience 198: 27–43. PMID 21925242. doi:10.1016/j.neuroscience.2011.08.067.
- Coincident but distinct messages of midbrain dopamine and striatal tonically active neurons.. Neuron 43 (1): 133–43. July 2004. PMID 15233923. doi:10.1016/j.neuron.2004.06.012.
- Bergson, C; Mrzljak, L; Smiley, J. F.; Pappy, M; Levenson, R; Goldman-Rakic, P. S. (1995). Regional, cellular, and subcellular variations in the distribution of D1 and D5 dopamine receptors in primate brain. The Journal of neuroscience : the official journal of the Society for Neuroscience 15 (12): 7821–36. PMID 8613722.
- Inhibitory control of neostriatal projection neurons by GABAergic interneurons.. Nat Neurosci 2 (5): 467–72. May 1999. PMID 10321252. doi:10.1038/8138.
- Ibáñez-Sandoval, O; Tecuapetla, F; Unal, B; Shah, F; Koós, T; Tepper, JM (2010). Electrophysiological and morphological characteristics and synaptic connectivity of tyrosine hydroxylase-expressing neurons in adult mouse striatum.. J Neurosci 30 (20): 6999–7016. PMID 20484642. doi:10.1523/JNEUROSCI.5996-09.2010.
- Ibáñez-Sandoval, O; Tecuapetla, F; Unal, B; Shah, F; Koós, T; Tepper, JM (November 2011). A novel functionally distinct subtype of striatal neuropeptide Y interneuron.. J Neurosci 31 (46): 16757–69. PMID 22090502. doi:10.1523/JNEUROSCI.2628-11.2011.
- English DF, Ibanez-Sandoval O, Stark E, Tecuapetla F, Buzsáki G, Deisseroth K, Tepper JM, Koos T. Nat Neurosci. 2011 Dec 11;15(1):123-30. doi: 10.1038/nn.2984.
- Neuron-generating brain region could hold promise for neurodegenerative therapies. Science Daily. 20 лютого 2014. Процитовано 24 лютого 2014.
- Reinius B (27 березня 2015). Conditional targeting of medium spiny neurons in the striatal matrix.
- Anatomical re-evaluation of the corticostriatal projections to the caudate nucleus: a retrograde labeling study in the cat. Neurosci Res 34 (4): 257–69. 1999. PMID 10576548. doi:10.1016/S0168-0102(99)00060-7. Проігноровано невідомий параметр
|vauthors=(довідка) - Taylor SB, Lewis CR, Olive MF (February 2013).
- Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (вид. 2nd). New York: McGraw-Hill Medical. 2009. с. 147–148, 367, 376. ISBN 978-0-07-148127-4. «VTA DA neurons play a critical role in motivation, reward-related behavior (Chapter 15), attention, and multiple forms of memory. This organization of the DA system, wide projection from a limited number of cell bodies, permits coordinated responses to potent new rewards. Thus, acting in diverse terminal fields, dopamine confers motivational salience (“wanting”) on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). In this example, dopamine modulates the processing of sensorimotor information in diverse neural circuits to maximize the ability of the organism to obtain future rewards. ...
The brain reward circuitry that is targeted by addictive drugs normally mediates the pleasure and strengthening of behaviors associated with natural reinforcers, such as food, water, and sexual contact. Dopamine neurons in the VTA are activated by food and water, and dopamine release in the NAc is stimulated by the presence of natural reinforcers, such as food, water, or a sexual partner. ...
The NAc and VTA are central components of the circuitry underlying reward and memory of reward. As previously mentioned, the activity of dopaminergic neurons in the VTA appears to be linked to reward prediction. The NAc is involved in learning associated with reinforcement and the modulation of motoric responses to stimuli that satisfy internal homeostatic needs. The shell of the NAc appears to be particularly important to initial drug actions within reward circuitry; addictive drugs appear to have a greater effect on dopamine release in the shell than in the core of the NAc.» - Greengard, P (2001). The neurobiology of slow synaptic transmission. Science 294 (5544): 1024–30. PMID 11691979. doi:10.1126/science.294.5544.1024.
- Cachope, R; Cheer (2014). Local control of striatal dopamine release. Frontiers in Behavioral Neuroscience 8: 188. PMC 4033078. PMID 24904339. doi:10.3389/fnbeh.2014.00188.
- http://www.ucl.ac.uk/news/news-articles/0806/08062502
- Volman, S. F.; Lammel; Margolis; Kim; Richard; Roitman; Lobo (2013). New insights into the specificity and plasticity of reward and aversion encoding in the mesolimbic system. Journal of Neuroscience 33 (45): 17569–76. PMC 3818538. PMID 24198347. doi:10.1523/JNEUROSCI.3250-13.2013.
- The organization of the human striatum estimated by intrinsic functional connectivity. Journal of Neurophysiology 108 (8): 2242–2263. 2012. PMID 22832566. doi:10.1152/jn.00270.2012. Проігноровано невідомий параметр
|vauthors=(довідка) - Walker FO (January 2007). Huntington's disease. Lancet 369 (9557): 218–28. PMID 17240289. doi:10.1016/S0140-6736(07)60111-1.
- Nestler EJ (December 2013). Cellular basis of memory for addiction. Dialogues Clin. Neurosci. 15 (4): 431–443. PMC 3898681. PMID 24459410.
- Natural rewards, neuroplasticity, and non-drug addictions. Neuropharmacology 61 (7): 1109–22. Dec 2011. PMC 3139704. PMID 21459101. doi:10.1016/j.neuropharm.2011.03.010. Проігноровано невідомий параметр
|vauthors=(довідка) - Science Daily: Scientists pinpoint gene variations linked to higher risk of bipolar disorder
- MeSH Neostriatum
