Сульфат калію
Сульфа́т ка́лію — неорганічна сполука, калієва сіль сульфатної кислоти складу K2SO4. Речовина є білими орторомбічними кристалами.
| Сульфат калію | |
|---|---|
 | |
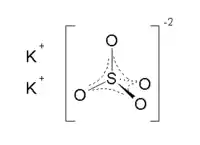 | |
| Назва за IUPAC | Калій сульфат |
| Ідентифікатори | |
| Номер CAS | 7778-80-5 |
| Номер EINECS | 231-915-5 |
| DrugBank | 14499 |
| KEGG | D01726 і C13192 |
| ChEBI | 32036 |
| RTECS | TT5900000 |
| SMILES |
[O-]S(=O)(=O)[O-].[K+].[K+][1] |
| InChI |
InChI=1S/2K.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
| Властивості | |
| Молекулярна формула | K2SO4 |
| Молярна маса | 174,261 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 2,66 г/см³ |
| Тпл | 1069 °C |
| Розчинність (вода) | 12,0 г/100 г |
| Розчинність (етанол) | нерозчинний |
| Структура | |
| Кристалічна структура | орторомбічна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-343,6 ккал/моль |
| Ст. ентропія S |
42,0 кал/(моль·K) |
| Теплоємність, c |
31,4 кал/(моль·K) |
| Пов'язані речовини | |
| Інші аніони | хлорид калію |
| Інші катіони | сульфат магнію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Використовується як калійні добрива. Також застосовується у виробництві галунів, скла.
Історія
Сульфат калію відомий з 14 століття, вперше його вивчав німецький алхімік Йоганн Рудольф Ґляубер (1604—1670), Роберт Бойль і Тахеніус.
Знаходження у природі
У вільному стані сульфат калію не зустрічається; він входить до складу мінералів, які є подвійними солями:
- каїніт, MgSO4·KCl·H2O
- шеніт, K2SO4·MgSO4·6H2O
- леоніт, K2SO4·MgSO4·4H2O
- лангбейніт, K2SO4·2MgSO4
- глазерит, K3Na(SO4)2
- полігаліт, K2SO4·MgSO4·2CaSO4·2H2O
- сингеніт, K2SO4·CaSO4·H2O
У природі зустрічається у родовищах калійних солей. Присутній у водах солоних озер.
Фізичні властивості
Сульфат калію добре розчиняється у воді, нерозчинний в етанолі.
| 0 °C | 10 °C | 20 °C | 25 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 7,11 | 8,46 | 9,95 | 10,7 | 11,4 | 12,9 | 14,2 | 15,5 | 16,7 | 17,7 | 18,6 | 19,36 |
Отримання
Виробництво сульфату калію можливе кількома способами в залежності від доступності та вартості обраної сировини.
Одним з найпоширеніших методів є добування солі з мінералу лангбейніту K2SO4·2 MgSO4. Після подрібнення з мінеральної сировини вимивають водою супутнього їй хлориду натрію, а згодом магнітною сепарацією відокремлюють іншу домішку — магнетит. Згодом очищену сіль обробляють водним розчином хлориду калію:
Після відфільтровування нерозчинних домішок, сульфат калію виокремлюють з розчину кристалізацією завдяки його меншій, ніж у хлориду магнію, розчинності.
Аналогічними є методи синтезу шляхом взаємодії хлориду калію з сульфатною кислотою та іншими сульфатами: Na2SO4, CaSO4·2H2O, FeSO4.
Також сульфат калію може бути отриманий реакцією обміну між гідроксидом калію та сірчаною кислотою (метод Мангейма):
За методом Гаргрівза K2SO4 можна синтезувати нагріванням суміші з хлориду калію, діоксиду сірки, повітря і води:
Хімічні властивості
Як сіль двоосновної кислоти утворює кислі солі:
Як всі сульфати взаємодіє з розчинними сполуками барію:
Відновлюється до сульфіду:
З оксидом сірки утворює піросульфат:
Застосування
Застосовується як калійне добриво, для одержання галуну, у виробництві скла, для отримання кислого сульфату калію (гідросульфату), що використовується як вибілювач у ювелірній справі. Крім того, застосовують як компонент флюсу у металургії, сульфуючий агент у виробництві барвників, в аналітичній хімії — для переведення важкорозчинних сполук у легкорозчинні.
В Європейському Союзі допущений як харчовий додаток — регулятор кислотності Е515.
Примітки
- POTASSIUM SULFATE
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Freilich M. B., Petersen R. L. Potassium compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 19. — P. 530-532. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Позин М. Е. Технология минеральных солей. — 4 изд. — Л., 1974. — Т. 1.
- Грабовенко В. А. Производство бесхлорных калийных удобрений. — Л., 1980.
- Переработка природных солей и рассолов / Под ред. И. Д. Соколова. — Л., 1985.
