Сульфат кальцію
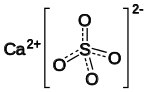
Сульфа́т ка́льцію, ка́льцій сульфа́т — неорганічна сполука, кальцієва сіль ряду сульфатів складу CaSO4. Речовина є білими, гігроскопічними кристалами, малорозчинними у воді. Утворює кристалогідрати складу CaSO4·2H2O та CaSO4·0,5H2O.
| Сульфат кальцію | |
|---|---|
 | |
 | |
| Назва за IUPAC | кальцій сульфат |
| Ідентифікатори | |
| Номер CAS | 7778-18-9 |
| Номер EINECS | 231-900-3 |
| DrugBank | 15533 |
| KEGG | D09201 |
| ChEBI | 31346 |
| RTECS | WS6920000 |
| SMILES |
[O-]S(=O)(=O)[O-].[Ca+2][1] |
| InChI |
InChI=1S/Ca.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
| Номер Гмеліна | 7487 |
| Властивості | |
| Молекулярна формула | CaSO4 |
| Молярна маса | 136,142 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 2,96 г/см³ |
| Тпл | 1460 °C |
| Розчинність (вода) | 0,205 г/100 г |
| Структура | |
| Кристалічна структура | орторомбічна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-342,76 ккал/моль |
| Ст. ентропія S |
25,50 кал/(моль·K) |
| Теплоємність, c |
23,82 кал/(моль·K) |
| Пов'язані речовини | |
| Інші аніони | сульфід кальцію |
| Інші катіони | сульфат магнію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Сульфат кальцію переважно застосовується у виготовленні будівельних матеріалів, зокрема як компонент цементів. Також він використовується як осушувач, кальцієвмісна харчова добавка, добриво.
Поширення у природі
Основна частина сульфат кальцію, розповсюдженого у природі, перебуває у вигляді двох основних мінералів: як ангідрит (CaSO4) та кристалогідрат сульфату — гіпс (CaSO4·2H2O). Дані мінерали лише зрідка трапляються у чистому вигляді, здебільшого вони мають домішки карбонатів кальцію та магнію, оксиду силіцію, невеликі вкраплення глин та деяких розчинних солей.
Окрім розповсюдження у земних надрах, за даними НАСА значні поклади гіпсу були знайдені на Марсі (за допомогою марсоходу «Опортюніті».[2]
Іншим розповсюдженим мінералом, що містить CaSO4, є глауберит Na2SO4·CaSO4. Також сульфат кальцію перебуває у морській воді. Так, у воді із середньою солоністю у 35‰ концентрація CaSO4 складає 0,00115 г/кг. Наявність його у воді визначає її постійну твердість.
Фізичні властивості
Сульфат кальцію є білими, гігроскопічними кристалами. Зволожений, він утворює дигідрат CaSO4·2H2O, який при невеликому нагріванні переходить у гемігідрат CaSO4·0,5H2O (2CaSO4·H2O) — так званий алебастр.
У воді речовина розчиняється слабко (добуток розчинності 4,93⋅10-5)
| 0 °C | 10 °C | 20 °C | 25 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 0,174 | 0,191 | 0,202 | 0,205 | 0,208 | 0,210 | 0,207 | 0,201 | 0,193 | 0,184 | 0,173 | 0,163 |
Отримання
Синтетичні методи отримання сульфату кальцію здебільшого базуються на добуванні його як побічного продукту при переробці мінеральної сировини або використанні у синтезі відходів інших виробництв.
Широко розповсюдженими є методи виробництва CaSO4, які використовують сульфуровмісні гази з переробки викопного палива (вугілля, лігніту, нафти). На першій стадії очищений від пилу оксид сірки(IV), впорскується у суспензію вапняку і за нейтрального pH (7—8) утворюється малорозчинний кристалогідрат сульфіту кальцію:
Згодом, у підкисленому розчині (pH 5), сульфіт окиснюється атмосферним киснем до сульфату:
Від отриманого малорозчинного гіпсу промиванням відокремлюють домішки хлоридів, солей магнію та висушують. Кінцевий технічний продукт має менше 10% вологи.
Іншим поширеним способом отримання сульфату кальцію є переробка флуорапатиту, яка є ключовим етапом у багатостадійному синтезі ортофосфатної кислоти:
Кінцевий продукт має вміст вологи близько 20—30%. З однієї тонни вихідного флуорапатиту утворюється близько 1,7 тонн сульфату. За цим методом щороку синтезується 100 млн. тонн сульфату кальцію.
Також сульфат кальцію утворюється при обробці флюориту сульфатною кислотою і добуванні газуватого фтороводню:
З однієї тонни флюориту утворюється 1,75 тонн сульфату кальцію.
Хімічні властивості
Сульфат кальцію активно поглинає вологу, утворюючи дигідрат:
При невеликому нагріванні дигідрату утворюється гемігідрат — алебастр, а при температурах, вищих за 163 °C — знову безводний сульфат:
Він взаємодіє із концентрованою сульфатною кислотою із утворенням кислої солі — гідросульфату кальцію:
Сульфат може вступати в реакції обміну за умови, якщо в результаті взаємодії утворюється нерозчинна сполука:
CaSO4 може відновлюватися CO або коксом до сульфіду кальцію:
Застосування

Основною галуззю, яка споживає сульфат кальцію, є будівництво — на виробництво будівельних матеріалів йде близько 90% усього сульфату (переважно у вигляді гідрату — гіпсу), а на виробництво цементу — 50% (сульфат кальцію є важливою добавкою до портландцементу).
Завдяки своїй високій гігроскопічності, сульфат широко використовується як осушувач. Наприклад, для осушування газів використовується трубка, наповнена сульфатом кальцію із кількавідсотковою добавкою хлориду кобальту(II) (суміш є зареєстрованою маркою Drierite). При граничному насиченні оcушувача вологою, він змінить колір із блакитного на рожевий, сигналізуючи про необхідність його заміни.
Сульфат кальцію також застосовується у сільському господарстві: для підживлення ґрунтів і підтримування балансу pH. У харчовій промисловості сульфат використовується як кальцієвмісна добавка, якою збагачують продукти на кшталт пластівців, як поліпшувач, коагулянт у виробництві тофу. Він є відбілювачем для споживчих продуктів: паперу, морозива, зубної пасти тощо.
Примітки
- CALCIUM SULFATE
- NASA Mars Rover Finds Mineral Vein Deposited by Water. 7.12.2012. Процитовано 6.05.2015. (англ.)
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Lancia A., Musmarra D., Prisciandaro M. Calcium Sulfate // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 4. — P. 418-422. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Myers Richard L. The 100 Most Important Chemical Compounds. — Westport, CT : Greenwood Press, 2007. — 326 p. — ISBN 978-0-313-33758-1. (англ.)
- Wirsching F. Calcium Sulfate // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
