Фенілоцтова кислота
Фенілоцтова кислота (α-толуілова кислота) - блискучі голки з запахом меду. Добре розчинна у діетиловому ефірі, етанолі та інших органічних розчинниках, погано розчиняється у воді. Широко розповсюджена у клітинах та біологічних рідинах живих організмів.
| Фенілоцтова кислота | |
|---|---|
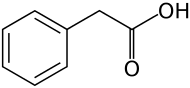 Структурна формула | |
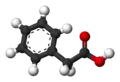 Кулько-стрижнева модель |
 |
| Назва за IUPAC | Phenylacetic acid |
| Ідентифікатори | |
| Номер CAS | 103-82-2 |
| Номер EINECS | 203-148-6 |
| DrugBank | 09269 |
| KEGG | C07086 |
| ChEBI | 30745 |
| SMILES |
O=C(O)Cc1ccccc1 |
| InChI |
1/C8H8O2/c9-8(10)6-7-4-2-1-3-5-7/h1-5H,6H2,(H,9,10) |
| Номер Бельштейна | 1099647 |
| Номер Гмеліна | 68976 |
| Властивості | |
| Молекулярна формула | C8H8O2 |
| Молярна маса | 136,15 г/моль |
| Густина | 1,0809 г/см3 |
| Тпл | 76-77 °C |
| Ткип | 265,5 °C |
| Кислотність (pKa) | 4.31[1] |
| Небезпеки | |
| MSDS | External MSDS |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Синтез
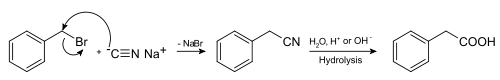
Більшість синтезів фенілоцтової кислоти виходять з бензилгалогенідів. Фенілоцтова кислота може бути синтезована гідролізом бензилнітрилау, який отримують, у свою чергу взаємодією бензилхлориду з ціанідом натрію [2]:
Інший метод синтезу — взаємодія бензилхлориду з магнієм і подальша взаємодія реактиву Гріньяра, що утворився, з вуглекислотою[3]:
- PhCH2Cl + Mg PhCH2MgCl
- PhCH2MgCl + CO2 PhCH2COOMgCl: PhCH2COOMgCl + H2O PhCH2COOH + Mg(OH)Cl
Фенілоцтова кислота також може бути синтезована карбонілюванням бензилового спирту у присутності родієвих каталізаторів[4]
Застосування
Фенілоцтову кислоту і її ефіри застосовують при складанні парфумерних композицій і харчових есенцій (як отдушку воску і меду). Фенілоцтова кислота служить вихідним продуктом для синтезу фенаміну, який має сильну стимулюючу дією і, внаслідок цього, входить до списку прекурсорів, які підлягають контролю. Додавання фенілоцтової кислоти в культуральні середовища використовується в мікробіологічному синтезі бензилпеніциліну плесенями Penicillium chrisogenumабоPenicillium notatum.
Знаходження в природі
Міститься в рослинах (зокрема, тютюні) і деяких ефірних оліях. За деякими даними, фенілоцтова кислота, синтезуєма рослинами, може проявляти ауксінподібну активність [5],[6].
У тварин фенілоцтова кислота синтезується з фенілаланіну через фенілпіровиноградну кислоту, у людини наявність фенілоцтової кислоти в сечі і поті при фенілкетонурії, яка обумовлює їх специфічний «мишачий» запах є одним з діагностичних ознак.
Література
- Бабаян Е. А., Гаєвський О. В., Бардін Є. В. «Правові аспекти обігу наркотичних, психотропних, сильнодіючих, отруйних речовин і прекурсорів» М.: МЦФЕР, 2000 стор 147
- Рабинович В. А., Хавін З. Я. «Короткий хімічний довідник» Л.: Хімія, 1977 стор 188
Примітки
- Dippy, J.F.J., Hughes, S.R.C., Rozanski, A., J. Chem Soc., 1959, 2492.
- Adams, Roger; Thal, A. F. (1963). Phenylacetic acid. Organic Syntheses 1: 436.
- X/2/ec8833324f7e488537a9d09c1f37b496 Robert A. Benkeser, Alvin E. Trevillyan, Jean M. Mallan, The reaction of the methylbenzylmagnesium halides with carbon dioxide, Journal of Organometallic Chemistry, Volume 2, Issue 4, October 1964, Pages 322–328, ISSN 0022-328X[недоступне посилання з жовтня 2019], DOI: 10.1016/S0022-328X (00) 82218-4 .
- Jiarong Duan, Jing Jiang, Junfang Gong, Qinghua Fan, Dazhi Jiang, Synthesis of phenylacetic acid by carbonylation, Journal of Molecular Catalysis A: Chemical, Volume 159, Issue 1, 22 September 2000, Pages 89-96, ISSN 1381-1169[недоступне посилання з липня 2019], DOI: 10.1016/S1381-1169 (00) 00175-8.
- Wightman, Frank; Lighty, Douglas L. (1982). Identification of phenylacetic acid as a natural auxin in the shoots of higher plants. Physiologia Plantarum 55: 17. doi:10.1111/j.1399-3054.1982.tb00278.x.
- Victoria Leuba; Duane LeTourneau. Auxin activity of phenylacetic acid in tissue culture. Journal of Plant Growth Regulation 9: 71–76. doi:10.1007/BF02041944.