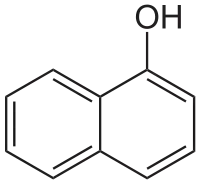
1-Нафтол
1-Нафтол (α-нафтол) — органічна сполука з формулою із класу фенолів. Є похідним нафталену, в якому атом H у α-позиції заміщений на гідроксильну групу. Ізомер 2-нафтолу.
| Структурна формула | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Загальна інформація | |||||||||||||
| Преференційна назва ІЮПАК | |||||||||||||
| Систематична назва ІЮПАК | Нафтален-1-ол | ||||||||||||
| Інші назви |
Альфа-нафтол, 1-нафтол, 1-гідроксинафтален | ||||||||||||
| Хімічна формула | C10H8O | ||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | ||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||
| |||||||||||||
| Властивості | |||||||||||||
| Молярна маса | 144.057515 г/моль | ||||||||||||
| Агрегатний стан |
Твердий | ||||||||||||
| Густина |
1.0954 г/см3 (98.7 °C) | ||||||||||||
| Температура плавлення |
95-96 °C | ||||||||||||
| Температура кипіння |
288,0 °C | ||||||||||||
| Температура самозаймання |
541,7 °C | ||||||||||||
| pKa |
9,34 (25°C) | ||||||||||||
| Розчинність |
866 мг/л (вода, 25 °C) | ||||||||||||
| Дипольний момент |
4,84*10-30 Кл*м (бензен, 25 °C) | ||||||||||||
| Термодинамічні властивості | |||||||||||||
| ΔcH⦵298 |
4957,4 кДж/моль (кристал, 298.16 °K) | ||||||||||||
| Безпека | |||||||||||||
| Маркування згідно системі УГС
Небезпека | |||||||||||||
| H-фрази | H: H302, H312, H315, H318, H335 | ||||||||||||
| P-фрази | P: P261, P264, P270, P271, P280, P301 + P312, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P312, P321, P322, P330, P332 + P313, P362, P363, P403 + P233, P405, P501 | ||||||||||||
| LD50 |
1870 мг/кг (щур, орально), 275 мг/кг (миша, орально) | ||||||||||||
| LC50 |
>420 мг/м3, 1 година (щур) | ||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||
Фізичні властивості
Має вигляд безбарвних призм при кристалізації з толуену. З води кристалізується у вигляді жовтих голок. Запах — слабкий фенольний, смак — пекучий та неприємний. Погано розчиняєься у воді, проте добре розчиняється в органічних розчинниках[1][2].
Отримання
Отримують сплавленням 1-нафтосульфонової кислоти з лугом при температурі 280-320 °С. Вихід — 93%[3][2][4]:
Більш сучасний метод отримання — гідроліз 1-нафтиламіну 22% водним розчином сульфатної кислоти при температурі 200°С під тиском. Нафтиламін отримують нітруванням нафталену з подальшим відновленням[3]:
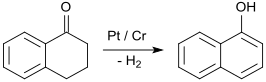
Також, 1-нафтол отримують каталітичним дегідруванням тетралону. Цей метод дозволяє отримувати більш чистий продукт[3]:
Хімічні властивості
Реакції за участі гідроксильної групи
Гідроксильна група проявляє кислотні властивості. Нафтол реагує з розчинами лугів, утворюючи солі, які, на відміну від самого нафтолу, розчинні у воді[2]:
У присутності кислот взаємодіє зі спиртами з утворенням етерів[2]:
1-Нафтол може й ацилюватися ангідридами чи хлороангідридами карбонових кислот[2]:
За допомогою пентахлориду фосфору гідроксильна група може бути заміщена на хлор з утворенням 1-хлоронафталену[3]:
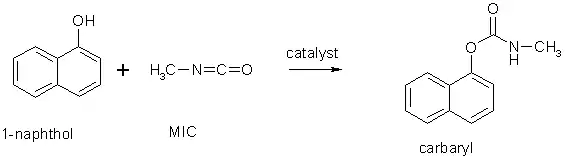
При взаємодії з метилізоціанатом утворює карбарил, який використовується для боротьби з дощовими черв'яками та гусеницями[3]:
При взаємодії з гідросульфітами утворюється гідросульфіта похідна, яка при взаємодії з надлишком аміаку перетворюється в 1-нафтиламін. Ця реакція є реакцією Бухерера[2]:

Гідрогенування
Може гідрогенуватися з утворенням 5,6,7,8-тетрагідро-1-нафтолу. Водень для цієї реакції утворюється при взаємодії натрію з рідким аміаком[3]:
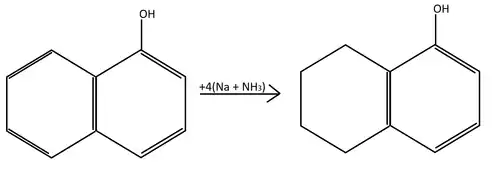
Такий самий продукт утворюється при гідруванні в кислому середовищі в присутності платини. Температура реакції — 70 °C, тиск — МПа. В лужному середовищі в присутності нікелю чи паладію водень приєднується до того ж кільця, де й гідроксигрупа, утворюючи 1-гідрокситетралін[2].
В присутності родію водень приєднується до двох ароматичний ядер, утворюючи 1-гідроксидекалін (1-декалол)[5].
Карбоксилювання
При 170 °C реагує з вуглекислим газом, утворюючи 1-гідроксинафтален-2-карбонову кислоту[2]:
Солі нафтолу також вступають в цю реакцію, утворюючи солі цієї кислоти[2].
Заміщення
Вступає у реакції електрофільного заміщення.
При хлоруванні гіпохлоритом натрію утворює 2-хлоро-1-нафтол, а при застосуванні сульфурил хлориду (SO2Cl2) продуктом реакції є 4-хлоро-1-нафтол. Якщо застосовувати хлор в оцтовій кислоті, утворюється 2,4-дихлоро-1-нафтол. Бром діє аналогічно, утворюючи 2,4-дибромо-1-нафтол.[2][3]
Сульфування 98% сульфатною кислотою призводить до утворення переважно 1-гідроксинафтален-2-сульфокислоти, є домішки 1-гідроксинафтален-4-сульфокислоти. При більшій кільості кислоти (2 молі на один моль нафтолу) утворюється 4-гідроксинафтален-1,3-дисульфокислота. При температурі 50 °C також утворюється 4-гідроксинафтален-1,3-дисульфокислота.[2][3]
Продукт нітрування залежить від розчинника: при застосуванні оцтової кислоти утворюється 2-нітронафтален-1-ол, а в хлороформі утворюється суміш 2-нітронафтален-1-олу та 4-нітронафтален-1-олу[2].
Може конденсуватися з нітрозосполуками. Наприклад, реакція з N,N,-диметил-4-нітрозоаніліном веде до утворення барвнику індофенолового синього:[3]
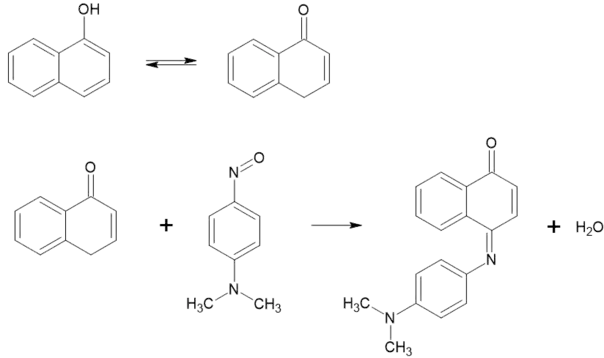
Може вступати в реакцію азосполучення з діазосполуками. Зазвичай реагує в положенні 4 до гідроксигрупи, а в сильнолужному середовищі — в положенні 2 (лише з деякими діазосполуками). Продукти цих реакцій застосовують як барвники[3].
Токсичність
Помірно токсичний, пил може викликати подразнення шкіри та пошкодження очей[3]. Також подразнює дихальну систему, шкодить крові і ниркам[6].
Про репродуктивну токсичність, мутагенність і канцерогенність достатньої кількості інформації немає.[6]
Метаболізм
В організмі 1-нафтол перетворюється наступним чином: спочатку окиснюється до 1-нафтол-3,4-оксид, який далі гідролізується до 1,3,4-тригідроксидигідронафталену. Останній дегідратується, але при цьому вже утворюється 1,4-дигідроксинафтален, який далі окиснюється до 1,4-нафтохінону.[7]
Застосування
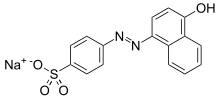
1-Нафтол застосовують для отримання барвників. Азобарвники утворюються при реакції 1-нафолу з різними діазосполуками, але він використовуєтья набагато менше, ніж 2-нафтол. 2,4-динітро-1-нафтол раніше використовувався як жовтий барвник. Також, з 1-нафтолу отримується індофеноловий синій.[3]
Етери за естери застосовують у медицині: 1-нафтилсаліцилат — антисептик та протиревматичний препарат, а 1-ізопропіламіно-3-(1-нафтокси)-пропан-2-ол використовується для лікування серця.[3]
Примітки
- PubChem. 1-Naphthol. pubchem.ncbi.nlm.nih.gov (англ.). Процитовано 31 жовтня 2020.
- Нафтолы // Химическая энциклопедия : в 5 т. / гл. ред. И. Л. Кнунянц. — М. : Большая Рос. энцикл., 1992. — Т. 3 : Меди сульфиды — Полимерные красители. — Стб. 387. — Библиогр. в конце ст. — ISBN 5-85270-039-8.(рос.)
- Booth, Gerald (15 червня 2000). У Wiley-VCH Verlag GmbH & Co. KGaA. Naphthalene Derivatives. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a17_009. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a17_009.
- Нейланд, О.Я. (1990). Органическая химия (російська). Москва: Высшая школа. ISBN 5-06-001471-1.
- HYDROGENATION OF AROMATIC NUCLEI: 1-DECALOL. Organic Syntheses 51. 1971. с. 103. doi:10.15227/orgsyn.051.0103. Процитовано 10 січня 2021.
- GESTIS Substance Database. gestis-database.dguv.de. Процитовано 11 січня 2021.
- Kumagai, Yoshito; Shinkai, Yasuhiro; Miura, Takashi; Cho, Arthur K. (10 лютого 2012). The Chemical Biology of Naphthoquinones and Its Environmental Implications. Annual Review of Pharmacology and Toxicology (англ.) 52 (1). с. 221–247. ISSN 0362-1642. doi:10.1146/annurev-pharmtox-010611-134517. Процитовано 26 травня 2021.