4-нітрофенол
4-нітрофенол (пара-нітрофенрол) ― органічна сполука з класу нітрофенолів. Є ізомером 2-нітрофенолу та 3-нітрофенолу.
| Структурна формула | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
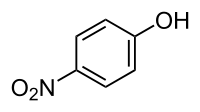 | ||||||||||||||||
| Загальна інформація | ||||||||||||||||
| Преференційна назва ІЮПАК | 4-нітрофенол | |||||||||||||||
| Систематична назва ІЮПАК | 4-нітрофенол | |||||||||||||||
| Інші назви |
пара-нітрофенол, 4-гідроксинітробензен | |||||||||||||||
| Хімічна формула | C6H5NO2 | |||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | |||||||||||||||
| Зовнішні ідентифікатори / Бази даних | ||||||||||||||||
| ||||||||||||||||
| Властивості | ||||||||||||||||
| Молярна маса | 139,11 г/моль | |||||||||||||||
| Агрегатний стан |
Тверда речовина | |||||||||||||||
| Густина |
1,48 г/см3 (20 °C) | |||||||||||||||
| Температура плавлення |
110 °C - 115 °C | |||||||||||||||
| Температура кипіння |
розкладається | |||||||||||||||
| Температура самозаймання |
490 °C - 510 °C | |||||||||||||||
| Розчинність |
10 г/л (H2O, 10 °C) 14,8 г/л (H2O, 25 °C) | |||||||||||||||
| Безпека | ||||||||||||||||
| Маркування згідно системі УГС
Небезпека | ||||||||||||||||
| H-фрази | H: H301, H312, H332, H373 | |||||||||||||||
| P-фрази | P: P261, P271, P280, P302+P352, P310, P501 | |||||||||||||||
| EUH-фрази | EUH: Заходи безпеки відсутні | |||||||||||||||
| LD50 |
202 мг/кг (щур, орально) | |||||||||||||||
| Вибухонебезпечність | ||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | ||||||||||||||||
Фізичні властивості

За стандартних умов 4-нітрофенол є твердою речовиною. Має дві кристалічні форми: α та β. Перша з них утворюється при кристалізації з толуену за температури понад 63 °С і є нестабільною, друга стабільна, має жовтий колір, утворюється при кристалізації з толуену за температури нижче 63 °С.[1]
Порівняно з 2-нітрофенолом, 4-нітрофенол не летючий і добре розчиняється в воді.[1]
Отримання
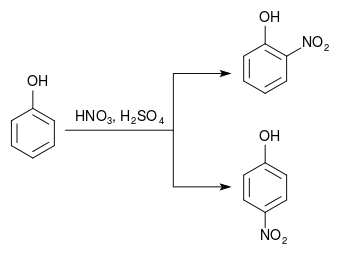
Нітруванням фенолу

При нітруванні фенолу утворюється суміш 2-нітрофенолу та 4-нітрофенолу. Оскільки 2-нітрофенол більш летючий, ніж 4-нітрофенол, продукти можна розділити дистиляцією.[1]
Гідролізом 4-хлоронітробензену
Гідроліз 4-хлоронітробензену економічно вигідніший за нітрування фенолу, тому саме ця реакція є основним джерелом одержання 4-нітрофенолу. Проврдять реакцію наступним чином: 4-хлоронітробензен розчиняють у 8,5% розчині гідроксиду натрію, поступово нагрівають до 170 °С та тримають в автоклаві протягом 8 годин.[1]
Застосування
Застосовується як pH-індикатор: при зміні pH від 5,4 до 7,5 відбувається перехід від безбарвного до жовтого кольору.[2]
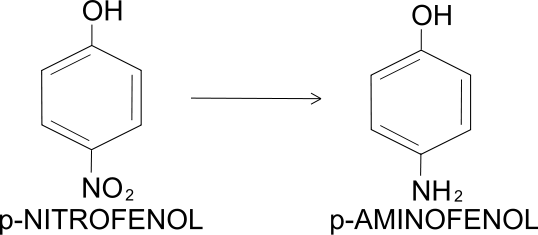
Також застосовується для отримання 4-амінофенолу:[3]
Токсичність
Подразнює шкіру та слизові оболонки. За умов хронічного впливу може пошкоджувати транспорт кисню в крові. Даних про мутагеннсіть та канцерогенність недостатньо для висновків.[4]
Джерела
- Booth, Gerald (15 червня 2000). У Wiley-VCH Verlag GmbH & Co. KGaA. Nitro Compounds, Aromatic. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a17_411. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a17_411.
- 4-Nitrophenol CAS 100-02-7 | 106798. www.merckmillipore.com. Процитовано 28 жовтня 2016.
- Mitchell, Stephen C.; Waring, Rosemary H. (15 вересня 2000). У Wiley-VCH Verlag GmbH & Co. KGaA. Aminophenols. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a02_099. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a02_099.
- GESTIS Substance Database. gestis-database.dguv.de. Процитовано 21 листопада 2021.


