BRCA1
BRCA1 та BRCA1 — людський ген та відповідний протеїн. [1] Використовуються наступні позначення: BRCA1, косий шрифт для гену та BRCA1, прямий шрифт для проетеїну. Офіціна назва (breast cancer 1) підтримується HGNC. Гомологи, Brca1 та Brca1 відомі у інших ссавців.[2] BRCA1 є людським геном-супрессором пухлин[3][4]; ген та протеїн, що з нього експресуються відповідають за репарацію ДНК.[5]
| BRCA1 | |
|---|---|
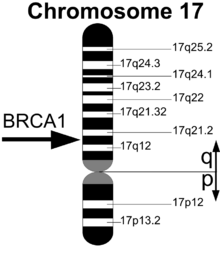 Розташування гену BRCA1 на хромосомі 17 | |
| Ідентифікатори | |
| Символ | BRCA1 |
| Інші символи | breast cancer 1, early onset, BRCAI, BRCC1, BROVCA1, IRIS, PNCA4, PPP1R53, PSCP, RNF53, FANCS, breast cancer 1 |
| Entrez | |
| OMIM | |
| PDB | 1JNX, 1N5O, 1OQA, 1T15, 1T29, 1T2U, 1T2V, 1Y98, 2ING, 3COJ, 3K0H, 3K0K, 3K15, 3K16, 3PXA, 3PXB, 3PXC, 3PXD, 3PXE, 4IFI, 4IGK, 4JLU, 4OFB, 4U4A, 4Y18, 4Y2G 1JM7, 1JNX, 1N5O, 1OQA, 1T15, 1T29, 1T2U, 1T2V, 1Y98, 2ING, 3COJ, 3K0H, 3K0K, 3K15, 3K16, 3PXA, 3PXB, 3PXC, 3PXD, 3PXE, 4IFI, 4IGK, 4JLU, 4OFB, 4U4A, 4Y18, 4Y2G |
| RefSeq | |
| UniProt | |
| Інша інформація | |
| Локус | Хр. 17 |
BRCA1 та BRCA2 експресуються в тканинах молочних залоз та інших органів, де вони беруть участь в усуненні пошкоджень ДНК або в знищенні клітин в яких репарація ДНК неможлива. Ці білки відповідальні за відновлення пошкоджених хромосом із особливою роллю в ремонтуванні двуланцюгових розривів (DNA double-strand breaks).[6][7] Якщо BRCA1 або BRCA2 пошкоджені мутаціями, блокується процес ремонтування ДНК, що підвищує ризик виникнення раку молочної залози.[8][9]
Спосіб скринінгу пацієнтів на вірогідність розвитку раку молочної залози в майбутньому через мутації в BRCA1 та BRCA2 був запатентований компанією Myriad Genetics.[10][11] Завдяки цій технології Myriad пройшла шлях від стартапу заснованого в 1994 році до великої компанії зі штатом в 1200 працівників та річним прибутком $500 млн в 2012 році.[12] Виникало багато суперечок щодо високої вартості діагностики та неможливості проводити аналогічні тести в інших лабораторіях; це призвело до епохального судового процесу «Асоціація молекулярної патології проти Myriad Genetics» (Association for Molecular Pathology vs. Myriad Genetics).[13]
BRCA1 разом з іншими супресорами пухлин, сесорами пошкодження ДНК та сигнальними протеїнами утворюють багатокомпонентний білковий комплекс відомий як BRCA1-асоційований комплекс спостереження за геномом (BRCA1-associated genome surveillance complex, BASC).[14] Білок BRCA1 асоціюється з РНК-полімеразою ІІ, а також через С-кінцевий домен взаємодіє з гістон-деацетилазним комплексом. Таким чином, цей білок відіграє роль в транскрипції, репарації дволанцюгових розривів в ДНК,[9] убіквітинилюванні та інших процессах.[15]
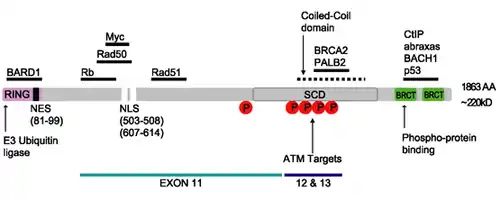
Ензим BRCA1 людини містить чотири основних домени: цинковий палець Znf C3HC4, BRCA1 сериновий домен та два BRCT домени.
Відомості про ген
Людський ген BRCA1 розташований на довгому плечі хромосоми 17, область 2 смуга 1, від пари основ 41,196,312 до пари основ 41,277,500 (білд геному GRCh37/hg19).[17] Гомологи BRCA1[2] були ідентифіковані у більшості ссавців геноми яких були секвеновані.
Відкриття
Перші докази існування гену що кодує ДНК-репаруючий ензим що спричиняє виникнення раку молочної залози були знайдені в лабораторії Марі-Клер Кінг (Mary-Claire King) в Університеті Берклі в 1990 році.[18] Після чотирьох років напружений пошуків силами багатьох лабораторій,[19] цей ген був клонований в 1994 році науковцями з Університету Юти, Національного Інституту Наук про Здоров*я та Навколишнє Середовище (National Institute of Environmental Health Sciences, NIEHS) та Myriad Genetics.[10][20]
Структура протеїну
Білок BRCA1 містить наступні домени:[21]
- «цинковий палець» типу C3HC4 (RING finger)
- BRCA1 C-термінальний домен (BRCT)
Білок також містить сигнальні пептиди ядерної локалізації (nuclear localization signal) та ядерного експорту (nuclear export signal).[22]
Домен «цинковий палець»
BRCA1 серин-кластерний домен (serine cluster domain, SCD) розташований в районі амінокислотних залишків 1280—1524. Частина домену розташована в екзонах 11–13, в яких спостерігається висока частота мутацій. Відомі сайти фосфориляції BRCA1 сконцентровані в SCD. Фосфориляція кіназами ATM/ATR відбувається як in vitro та in vivo. ATM/ATR кінази активуються при пошкодженні ДНК. Мутації залишків серину можуть вплинути на локалізацію BRCA1 біля сайтів пошкодження ДНК та на його ДНК-репаруючу роль.[16][23]
Серин-кластерний домен
RING домен є важливим елементом убіквітин E3 лігази, яка каталізує убіквітилювання протеїну. Убіквітин є невеликим регуляторним протеїном що регулює компартменталізацію протеїнів в клітині. BRCA1 поліпептид, а саме Lys-48-пов'язаний поліубіквітин рівномірно розповсюджені в ядрі клітини у стані спокою. Але після початку реплікації ДНК ці білки кластерізуються утвоючи агрегати що також містять BRCA2 та BARD1. Вважається що BARD1 бере участь у розпізнаванні та зв'язуванні з протеїнами-мішенями для убіквітинилювання.[24] Він приєднується до білків та мітить їх для знищення. Убіквітилювання відбувається через BRCA1-об'єднаний білок та порушується при хелації цинку.[25]
RING-мотив, домен типу «цинковий палець» зазвичай має довжину в 40–60 амінокислот та містить вісім консервативних метал-зв'язувальних амінокислотних залишків, два квартети цистеїнів або гістидинів, які координують два атоми цинку.[25] Цей мотив містить короткий анти-паралельний бета-лист, два цинк-зв'язуючих сайти та центральну альфа-спіраль. RING-домен взаємодіє з асоційованими протеїнами, в тому числі з BARD1, який також має RING мотив, утворюючи гетеродимер. BRCA1 RING мотив з обох боків оточений альфа-спіралями утвореними амінокслотами номер 8–22 та 81–96 поліпептиду BRCA1. Він взаємодіє з гомологічною ділянкою BARD1 утвореною іншим RING оточеним двома альфа спіралями (амінокислотні залишки номер 36–48 та 101—116). Ці чотири спіралі об'єднуються утворючи гетеродимеризаційний інтерфейс та стабілізують BRCA1-BARD1 гетеродимер. Додаткова стабілізація досягається взаємодією між суміжними амінокислотними залишками в обрамлюючих ділянках та гідрофобними взаємодіями. BARD1/BRCA1 взаємодії порушуються канцерогенними мутаційними замінами амінокислот в BRCA1, що припускає що утворення стабільного комплексу між цими білками є важливим аспектом функціонування BRCA1 як супрессора пухлин.[25]
Посилання
- Hamel PJ (2007-05-29).
- «OrthoMaM phylogenetic marker: BRCA2 coding sequence»[недоступне посилання з лютого 2019].
- Duncan JA, Reeves JR, Cooke TG (October 1998).
- Yoshida K, Miki Y (November 2004).
- Check W (2006-09-01).
- Friedenson B (August 2007).
- Friedenson B (2008-06-08).
- «Breast and Ovarian Cancer Genetic Screening».
- Friedenson B (2007).
- US patent 5747282, Skolnick HS, Goldgar DE, Miki Y, Swenson J, Kamb A, Harshman KD, Shattuck-Eidens DM, Tavtigian SV, Wiseman RW, Futreal PA, «7Q-linked breast and ovarian cancer susceptibility gene», issued 1998-05-05, assigned to Myriad Genetics, Inc., The United States of America as represented by the Secretary of Health and Human Services, and University of Utah Research Foundation
- US patent 5837492, Tavtigian SV, Kamb A, Simard J, Couch F, Rommens JM, Weber BL, «Chromosome 13-linked breast cancer susceptibility gene», issued 1998-11-17, assigned to Myriad Genetics, Inc., Endo Recherche, Inc., HSC Research & Development Limited Partnership, Trustees of the University of Pennsylvania
- Myriad Investor Page—see «Myriad at a glance» Архівовано 18 жовтень 2012 у Wayback Machine. accessed October 2012
- Schwartz J (2009-05-12).
- Wang Y, Cortez D, Yazdi P, Neff N, Elledge SJ, Qin J (April 2000).
- Starita LM, Parvin JD (2003).
- Clark SL, Rodriguez AM, Snyder RR, Hankins GD, Boehning D (April 2012).
- National Center for Biotechnology Information, U.S. National Library of Medicine EntrezGene reference information for BRCA1 breast cancer 1, early onset (Homo sapiens)
- Hall JM, Lee MK, Newman B, Morrow JE, Anderson LA, Huey B, King MC (December 1990).
- High-Impact Science: Tracking down the BRCA genes (Part 1) — Cancer Research UK science blog, 2012
- Miki Y, Swensen J, Shattuck-Eidens D, Futreal PA, Harshman K, Tavtigian S, Liu Q, Cochran C, Bennett LM, Ding W (October 1994).
- Paterson JW (February 1998).
- Henderson BR (September 2005).
- Beckta JM, Dever SM, Gnawali N, Khalil A, Sule A, Golding SE, Rosenberg E, Narayanan A, Kehn-Hall K, Xu B, Povirk LF, Valerie K (Sep 2015).
- Baer R (October 2001).
- Brzovic PS, Rajagopal P, Hoyt DW, King MC, Klevit RE (October 2001).