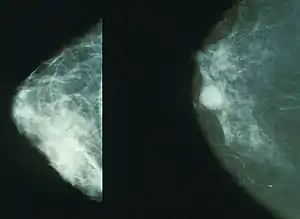
Рак молочної залози
Рак молочної залози (англ. Breast cancer) — злоякісна пухлина залозистої тканини молочної залози. Найчастіша форма раку в світі, протягом життя трапляється у однієї з 13-ти — 9-ти жінок віком від 13 до 90 років. Також це друге за частотою після раку легень онкологічне захворювання в популяції загалом (враховуючи чоловіче населення). Кількість випадків раку молочної залози в розвинених країнах різко зросла після 1970-х років. Це пояснюють, зокрема, зміною стилю життя населення розвинутих країн (наприклад, в сім'ях зменшилася кількість дітей і термін годування грудьми скоротився[уточнити]).
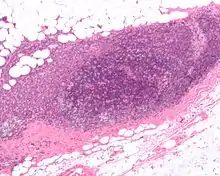
Оскільки молочна залоза складається з однакових тканин у чоловіків та жінок, рак молочної залози іноді трапляється і в чоловіків (менше 1 % від загальної кількості хворих).
Фактори ризику
Фактори ризику розділяються на ті, на які можна впливати, ті, на які не можна впливати, та репродуктивні[6].
Фактори ризику, на які не можна впливати
- Вік
- Генетична схильність
- Доброякісні передракові захворювання молочної залози
- Рак молочної залози в анамнезі
- Щільність молочної залози
- Опромінення грудної клітки в анамнезі
- Менструальний анамнез
Фактори ризику, на які можна впливати
- Відсутність грудного вигодовування[джерело?]
- Ожиріння
- Цукровий діабет 2 типу
- Нераціональна дієта та дефіцит вітаміну Д
- Стероїдні гормони, в тому числі тривале застосування гормональних контрацептивів
- Зловживання алкоголем
- Тютюнопаління
- Нічний режим роботи
- Недостатня фізична активність
- Токсичні речовини
Репродуктивні фактори
- Відсутність вагітностей та пологів у віці понад 30 років[джерело?]
У більшості випадків рак молочної залози спорадичне захворювання, але в 5-10 % може бути спадковим та проявляється внаслідок мутацій у генах BRCA1 та BRCA2, що призводить до виникнення раку молочної залози в 60-80 % випадків[7], що в деяких країнах Європи є показаннями до профілактичної мастектомії.[8] Крім того, вік та жіноча стать також підвищують ризик розвитку новоутворення, частка якого у осіб чоловічої статі значно нижча.[9] Інші потенційні фактори ризику: відсутність пологів та вигодовування груддю[10],підвищений рівень естрогенів.[11][12].
Підвищений вміст 16α-OHE1 — метаболіту із агресивними властивостями — розглядається як чинник ризику розвитку раку молочної залози[13].
Діагностика
Клінічно, на ранній стадії рак молочної залози проявляється щільним утворенням у молочній залозі або збільшеними пахвинними лімфатичними вузлами при метастазах. Проте при прогресуванні хвороби, швидкий ріст пухлини призводить до значних дефектів молочної залози, що проявляється некрозами, виразками та іншими ознаками розпаду злоякісної пухлини.
Діагноз РМЗ повинен складатись з двох параметрів — стадія хвороби (ступінь розповсюдженості пухлини організмом), з використанням міжнародної системи T (розмір пухлини) N (статус регіонарних лімфатичних вузлів) M (віддалені метастази) G (ступінь диференціації пухлинних клітин), та біологічні характеристики пухлини, що включає рецепторний статус (наявність у пухлинних клітинах рецепторів до естрогену та прогестерону), індекс проліферації ракових пухлин Кі67 та наявність чи відсутність гіперекспресії ERBB2 (Her2/neu).
Для підтвердження діагнозу проводиться мамографія, УЗД молочної залози та при наявності підозрілих утворень тонкоголкова аспіраційна пункційна біопсія з подальшим цитологічним дослідження біоптату. Цей метод не є точним та специфічним, а також не виявляє біологічні характеристики пухлини, що не дозволяє проводити адекватного планування лікування. Набагато точнішим методом є товстоголкова біопсія з гістологічним дослідженням пунктату. Якщо діагноз раку підтверджено, необхідно визначити присутність чи відсутність метастаз. Залежно від розміру первинної пухлини, її агресивності та стану регіонарних лімфовузлів, проводяться такі обстеження[14]:
- Мамографія та рентгенографія органів грудної клітки.
- УЗД органів черевної порожнини.
- Комп'ютерна томографія органів грудної та черевної порожнини та малого тазу (КТ ОГК, ОЧП, ОМТ).
- Остеосцинтіграфія.
- Можливе проведення позитронно-емісійної томографії (ПЕТ-КТ).
Гістологічна класифікація пухлин молочної залози
До основних гістологічних типів раку молочної залози відносять[джерело?]:
Молекулярна класифікація пухлин молочної залози
Молекулярна класифікація базується на визначенні наявності або відсутності на поверхні і в середині пухлинних клітин рецепторів до естрогенів (ER, від англ. Estrogen Receptor) і прогестерону (PR, від англ. Progesterone Receptor), рецепторів до епідермального фактора росту HER2/neu (укр. — хертунеу) та деяких інших молекулярних і генетичних маркерів[джерело?].
- Люмінальний А підтип раку молочної залози.
- Люмінальний Б підтип раку молочної залози.
- HER/2 позитивний підтип раку молочної залози.
- Потрійно-негативний підтип раку молочної залози.
Профілактика
З 1995 року овочі сімейства капустяні за рекомендаціями Всесвітнього фонду дослідження раку вважаються джерелом біологічно активних речовин, які мають найбільшу антиканцерогенну, антипроліферативну й антимутагенну активність, та включені у перелік найнеобхідніших рослинних груп для правильного життєзабезпечення організму[16].
Лікування
- Стадія 1 та 2 — ефективне лікування в більшості випадків та сприятливий прогноз. Хірургічне лікування може бути органозберігаючим, в об'ємі видалення пухлини в межах здорових тканин, що повинна супроводжуватись подальшим курсом променевої терапії[17], або в об'ємі мастектомії з можливою реконструкцією молочної залози. Органозберігаюча хірургія з подальшою променевою терапією дає такий самий онкологічний результат, як і мастектомія[18]. Хіміотерапія, таргетна та/або антигормональна терапія призначаються в залежності від біологічних характеристик пухлини. При хірургічному лікуванні вкрай бажано використовувати принципи онкопластичної та реконструктивної хірургії, що дозволяє уникнути грубих деформацій залози та, навіть, покращити її зовнішній вигляд. Якщо при передопераційному обстеженні не виявлено ураження регіонарних лімфатичних вузлів, необхідно проводити біопсію сигнального регіонарного лімфовузла для визначення ступеня ураження всіх інших регіонарних лімфатичних вузлів і, відповідно, необхідності їх видалення. Оскільки імовірність метастазування в регіонарні лімфовузли в такій ситуації не більше 30 %, а видалення здорових лімфатичних вузлів лише збільшує імовірність ускладнень[19].
- Стадії 3. Характеризується менш сприятливим прогнозом, оскільки має більш високий ризик рецидиву. Лікувальна стратегія при карциномах у цій стадії полягає в проведенні розширеного хірургічного лікування, зокрема мастектомії, хоча органозберігаюча операція в об'ємі видалення пухлини в межах здорових тканин також можлива. Це залежить від співвідношення розміру залози та пухлини. Обов'язковим є проведення хіміотерапії, таргетної та антигормональної терапії в залежності від гормонального статусу пухлини. Променева терапія проводиться після хірургічного втручання, якщо була проведена органозберігаюча операція, якщо пухлина була розміром більше 5 см (навіть після мастектомії) та при наявності ураження регіонарних лімфовузлів[20].
- Стадія 4. Прогноз несприятливий. При цій стадії наявні віддалені метастази. Лікування передбачає хіміотерапію, антигормональну та таргетну терапію. Хірургічне та променеве лікування застосовується лише у випадках ускладнень, що потребують швидкого місцевого ефекту від лікування. Показник 10-річного виживання при цій стадії становить 5 % без проведення лікування, та близько 10 % при проведенні.[21]
Хірургічне лікування
Виконується видалення пухлини та прилеглих до неї тканин, а також сигнального регіонарного вузла.
Класифікація операцій:
- Мастектомія: повне видалення паренхіми молочної залози. При цьому можливе збереження шкіри залози і навіть сосково-ареолярного комплексу, що використовується для подальшої реконструкції. Збереження шкіри та цього комплексу можливе при відсутності інфільтрації їх пухлиною, та за умови підтвердження цього при інтраопераційному гістологічному контролі. Реконструкції молочної, як з використанням імплантів, так і власних тканин пацієнтки — не збільшують імовірність рецидиву пухлини. Вони можуть бути одномоментними (проводяться в одну операцію) чи відтермінованими (проводяться після закінчення онкологічного етапу лікування)[22].
- Квадрантектомія: видалення одного з 4 квадрантів молочної залози. Метод є застарілим і в сучасній світовій практиці не використовується.
- Секторальна резекція: видалення сектору молочної залози. Метод є застарілим і в сучасній світовій практиці не використовується.
- Лампектомія: видалення пухлини в межах здорових тканин з відступом 0,5-1,0 см. Радикальною вважається операція, коли при остаточному патгістологічному дослідженні в краях резекції пухлину не виявляють[23]. При виконанні лампектомій необхідно враховувати естетичні результати операцій і планувати хірургічні доступи, видалення пухлин та закриття дефекту за принципами онкопластичної хірургії, що дозволяє не тільки покращити естетичні та функціональні результати операції, але і онколгогічні, оскільки зменшується рівень місцевих рецидивів[24].[25][26]
- Біопсія сигнального лімфовузла (БСЛВ): визначення, видалення та дослідження регіонарного лімфовузла, який знаходиться першим на шляху лімфовідтоку від пухлини в регіонарні лімфовузли. Як правило проводиться інтраопераційне дослідження регіонарного сигнального лімфовузла з використанням заморожених зрізів. При виявленні його ураження пухлиною виконують видалення пахвинних (аксилярних) лімфатичних вузлів 1-2 рівнів, оскільки в такому випадку ймовірність їх ураження складає коло 50 %. Біопсія сигнального регіонарного вузла є безпечною процедурою та дозволяє значно зменшити рівень ускладнень, пов'язаних з повною аксилярною лімфаденектомією. Виконується як етап при ламп- чи мастектомії[27].
- Аксилярна лімфаденектомія (АЛД): видалення регіонарних лімфатичних вузлів 1-2 та, інколи, 3-го рівня, за умови підтвердження їхнього ураження. Виконується як етап при ламп- чи мастектомії. Обов'язковим є визначення кількості лімфатичних вузлів та їх стану — (кількість уражених/кількість видалених). Адекватним є видалення не менше 10 лімфатичних вузлів. У 30 % пацієнтів, яким воно проведено, розвивається хронічний лімфостаз оперованої кінцівки. Виконання мастектомії може супроводжуватись одночасною реконструкцією, коли на місце видаленої тканини встановлюються імплантат(и) молочної залози.
Ад'ювантна терапія
Це вид терапії, який проводиться хворим на рак після операції (до операції ця терапія має назву неоад'ювантна). Наразі в медичному арсеналі є 3 типи засобів для ад'ювантної терапії раку молочної залози: гормональні, хіміопрепарати та моноклональні антитіла.
Блокатори естрогенових та прогестеронових рецепторів
- Гормональна терапія
Проводиться блокаторами естрогенів, які виділяє пухлина. Для проведення цього типу терапії необхідно проведення аналізу на наявність естрогенових (ER+) та прогестеронових рецепторів (PR+) на поверхні ракових клітин за допомогою імуногістохімії. Призначається тамоксифен (блокатор рецепторів) або інгібітори ароматази, що блокують власне синтез естрогенів[28]
Блокатори HER2
- Моноклональні антитіла
Використовують для лікування пацієнтів у яких позитивна експресія HER2 (HER2+), але ER- та PR-. Моноклональні антитіла показали високу ефективність, що проявляється покращенням показників виживання: 5 років для 1-3 стадії 87 %, загальне виживання 95 %.[29]
Потрійно-негативний рак
У приблизно 10 % хворих на рак молочної залози діагностуються повністю негативні пухлини (потрійно-негативні). Прогноз у такому випадку вкрай несприятливий, рекомендовано залучення до клінічних випробовувань або хіміотерапія препаратами циклофосфаміду.
Радіотерапія
Радіотерапія проводиться після хірургічного лікування з метою опромінення ділянки пухлини та знищення ракових клітин, що могли там залишитися.[30][31] Радіотерпія показала високу ефективність при огранозберігаючих операціях.
Примітки
- NDF-RT
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Inxight: Drugs Database
- Guidelines of the AGO Breast Committee Comission Mamma ((нім.)(англ.)).
- Gage, M; Wattendorf, D; Henry, LR (1 квітня 2012). Translational advances regarding hereditary breast cancer syndromes. Journal of surgical oncology 105 (5): 444–51. PMID 22441895. doi:10.1002/jso.21856.
- Unukovych, D; Sandelin K, Wickman M, Arver B, Johansson H, Brandberg Y, Liljegren A. (2012). Breast reconstruction in patients with personal and family history of breast cancer undergoing contralateral prophylactic mastectomy, a 10-year experience.. Acta Oncologica. [Epub ahead of print]. PMID 22409595.
- Reeder, JG; Vogel, VG (2008). Breast cancer prevention.. Cancer treatment and research 141: 149–64. PMID 18274088.
- Collaborative Group on Hormonal Factors in Breast Cancer (August 2002). Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50302 women with breast cancer and 96973 women without the disease.. Lancet 360 (9328): 187–95. PMID 12133652. doi:10.1016/S0140-6736(02)09454-0.
- Yager JD (2006). Estrogen carcinogenesis in breast cancer. New Engl J Med 354 (3): 270–82. PMID 16421368. doi:10.1056/NEJMra050776.
- Santoro, E., DeSoto, M., and Hong Lee, J (February 2009). Hormone Therapy and Menopause. National Research Center for Women & Families. Архів оригіналу за 12 липня 2013. Процитовано 6 серпня 2012.
- Xiangyan Ruan, Harald Seeger, Diethelm Wallwiener, Jens Huober, Alfred O Mueck - The Ratio of the Estradiol Metabolites 2-hydroxyestrone (2-OHE1) and 16α-hydroxyestrone (16-OHE1) May Predict Breast Cancer Risk in Postmenopausal but Not in Premenopausal Women: Two Case-Control Studies. PMID: 25318606 DOI: 10.1007/s00404-014-3512-1.
- https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf.
- Буквально в місці, тобто не є поширеним
- Т.Ф. Татарчук, Л.В. Калугина - К вопросу о профилактике и терапии гормонзависимых гиперпрофилеративных заболеваний у женщин.
- Surgery Choices for Women with Early Stage Breast Cancer. National Cancer Institute and the National Research Center for Women & Families. August 2004. Архів оригіналу за 12 липня 2013. Процитовано 6 серпня 2012.
- 1. Fisher B., Anderson S., Bryant J., Margolese R., Deutsch M., Fisher E., Jeong J.-H., Wolmark N. Twenty -year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer / N Engl J Med, Vol. 347, No. 16 October 17, 2002, P.- 1233—1241 2. Veronesi U, Cascinelli N, Mariani L, et al: Twenty-year follow-up of a randomized study сomparing breast-conserving surgery with radical mastectomy for early breast cancer. N Engl J Med 347:1227-1232, 2002 3. Clarke M, Collins R, Darby S, et al: Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: An overview of the randomised trials. Lancet 366:2087-2106, 2005 4. Blichert-Toft M., Nielsen M., Ring M., Moller S., Rank F., Overgraard M., Mouridsen H. Long-term results of breast conserving surgery vs. mastectomy for early stage invasive breast cancer: 20-year follow-up of the Danish randomized DBCG-82TM protocol. Acta Oncologica, 2008; 47: 672681 5. Alicheno, Morrow M. The Evolution of the Locoregional Therapy of Breast Cancer. The Oncologist 2011; 16: 1367—1379 6. Hwang E., Lichtensztajn D., Gomez S., Fowble B., Clarke C.. Survival After Lumpectomy and Mastectomy for Early Stage Invasive Breast Cancer The Effect of Age and Hormone Receptor Status. Cancer 2013; 119: 1402-11 7. Agarwal S, Pappas L, Neumayer L, Kokeny K, Agarwal J Effect of breast conservation therapy vs mastectomy on disease-specific survival for early-stage breast cancer JAMA Surg. 2014 Mar;149(3):267-74.
- 1. Clinical practice guidelines for the use of axillary sentinel lymph node biopsy in carcinoma of the breast: current update / Schwartz G. F. [et al.] // Breast J. — 2004. — Vol. 10 — P. — 85-98.
- https://www.nccn.org/professionals/physician_gls/pdf/breast.pdf
- Breast Cancer: Breast Disorders: Merck Manual Professional. Merck.com. Архів оригіналу за 12 липня 2013. Процитовано 14 листопада 2010.
- 1. Nava M., Catanuto G., Pennati A., Garganes G., Spano A. Conservative Mastectomies Aesth Plast Surg (2009) 33:681–686 2. Lanitis S, Tekkis PP, Sgourakis G, Dimopoulos N, Al Mufti R, Hadjiminas DJ. Comparison of skin-sparing mastectomy versus non-skin-sparing mastectomy for breast cancer: a meta-analysis of observational studies. Ann Surg. 2010 Apr;251(4):632-9. 3. Patani N, Mokbel K. Oncological and aesthetic considerations of skin-sparing mastectomy. [null Breast Cancer Res Treat.] 2008 Oct;111(3):391-403.
- 1. Neuschatz A.C., DiPetrillo T., Steinhoff M., et al. The value of breast lumpectomy margin assessment as a predictor of residual tumor burden in ductal carcinoma in situ of the breast. Cancer 94: 1917—1924, 2002. 2. Laucirica R. Intraoperative assessment of the breast: guidelines and potential pitfalls. Arch Pathol Lab Med. 2005 Dec;129(12):1565-74.
- 1. Audretsch W., Kolotas Ch, Rezai M, Schmitt G, Zamboglou N et al., Tumor-specific immediate reconstruction (TSIR) in breast cancer patients. Perspectives in Plast Surg, 11:71-106 1998. 2. Audretsch W. P. Reconstruction of the partial mastectomy defect: classification and method. In: Spear S.L., ed. Surgery of the breast: principle and art. 1998./ 3. Asgiersson K., Rached T., McCulley S.J., Macmillan R.D. Oncological and cosmetic outcomes of oncoplastic breast conserving surgery. Eur J Surg Oncol 31:817-23, 2005 4. Franceschini G, Terribile D, Magno S, Fabbri C, Accetta C, Di Leone A, Moschella F, Barbarino R, Scaldaferri A, Darchi S, Carvelli ME, Bove S, Masetti R./Update on oncoplastic breast surgery / Eur Rev Med Pharmacol Sci. 2012 Oct;16(11):1530-40.
- 1. Losken A, Dugal CS, Styblo TM, Carlson GW A meta-analysis comparing breast conservation therapy alone to the oncoplastic technique. Ann Plast Surg. 2014 Feb;72(2):145-9.
- 1. Clough K., Kaufman G., Nos C., Buccimazza I., Sarfati I., Improving Breast Cancer Surgery: A Classification and Quadrant per Quadrant Atlas for Oncoplastic SurgeryAnn Surg Oncol (2010) 17:1375–1391
- Huang TW, Kuo KN, Chen KH, Chen C, Hou WH, Lee WH, Chao TY, Tsai JT, Su CM, Huang MT, Tam KW. Recommendation for axillary lymph node dissection in women with early breast cancer and sentinel node metastasis: A systematic review and meta-analysis of randomized controlled trials using the GRADE system. Int J Surg. 2016 Aug 22;34:73-80
- Ting Bao, Michelle A Rudek (2011). The Clinical Pharmacology of Anastrozole. European Oncology & Haematology 7 (2): 106–8. Архів оригіналу за 19 квітня 2012. Процитовано 7 серпня 2012.
- Jahanzeb M (August 2008). Adjuvant trastuzumab therapy for HER2-positive breast cancer. Clin. Breast Cancer 8 (4): 324–33. PMID 18757259. doi:10.3816/CBC.2008.n.037.
- Massarut S, Baldassare G, Belleti B, Reccanello S, D'Andrea S, Ezio C, Perin T, Roncadin M, Vaidya JS (2006). Intraoperative radiotherapy impairs breast cancer cell motility induced by surgical wound fluid. J Clin Oncol 24 (18S): 10611. Архів оригіналу за 12 січня 2012. Процитовано 7 серпня 2012.
- Belletti B, Vaidya JS, D'Andrea S, et al. (March 2008). Targeted intraoperative radiotherapy impairs the stimulation of breast cancer cell proliferation and invasion caused by surgical wounding. Clin. Cancer Res. 14 (5): 1325–32. PMID 18316551. doi:10.1158/1078-0432.CCR-07-4453.
Джерела
- Клінічна хірургія/За ред. Л. Я. Ковальчука.- Укрмеднига: Тернопіль, 2000.- Т.2, 504 с. (С.348-357) ISBN 966-7364-27-5
- Факультетська хірургія: Курс лекцій: Навч. посібник / За ред. Б. С. Запорожченка. — Одеса: Одес. держ. мед. ун-т, 2005. — 328 с. — (Б-ка студента-медика). ISBN 966-7733-72-6 (С.87-96)
Література
- Рак молочної залози у жінок: управління факторами ризику: (монографія) / Рудень В. В., Москвяк-Лесняк Д. Є. — Львів: ЛНМУ ім. Д. Галицького, 2017. — 143, [1] с. : іл., табл., портр. — Бібліогр.: с. 102—129. — ISBN 978-617-7196-01-2
Посилання
| 1. Як виникає рак і як його лікувати - все про лікування онкології // Канал Tokar.ua українською» на YouTube, 26 серпня 2020. | |
- Стаття розділу «Прояви, діагностика й лікування різних форм рака»: Рак молочної залози
- Рак молочної залози: міфи і правда
- Рак молочної залози можна вилікувати
- Рак виліковний. Не зволікай: Рак молочної залози
- Рак молочної залози на ранніх стадіях можна вилікувати
- Фактори ризику раку молочної залози || Рак молочної залози || Хвороба Педжета соска || Запальний рак молочної залози
- Обізнаність — Високоефективна зброя проти раку молочної залози
- Рак молочної залози. Поради лікаря[недоступне посилання з липня 2019]